Viktoza - instrucións oficiais * de uso
Forma de dosificación - solución para administración subcutánea: incoloro ou case incoloro (3 ml cada un * en cartuchos de vidro, que están selados nunha pluma de xeringa desbotable de plástico para inxeccións múltiples, nun feixe de cartón de 1, 2 ou 3 plumas de xeringa).
* En 1 xeringa (3 ml) contén 10 doses de 1,8 mg, 15 doses de 1,2 mg ou 30 doses de 0,6 mg.
Substancia activa: liraglutido, en 1 ml - 6 mg.
Compoñentes auxiliares: ácido clorhídrico / hidróxido de sodio q.s., hidróxido fosfato sódico dihidrato, fenol, propilenglicol, auga para a inxección.
Propiedades farmacolóxicas:
Farmacodinámica
O liraglutido ten un longo efecto de 24 horas e mellora o control glicémico ao diminuír a concentración de glicosa en sangue en xaxún e despois de comer en pacientes con diabetes tipo 2.
Secreción de insulina dependente da glicosa
Cun aumento da concentración de glicosa no sangue, o liraglutido aumenta a secreción de insulina. Cando se usa infusión de glucosa por paso, a secreción de insulina despois da administración dunha única dose de liraglutido a pacientes con diabetes mellitus tipo 2 aumenta ata un nivel comparable ao de suxeitos saudables (Fig. 1).

Función pancreática de células beta
O liraglutido mellorou a función das células beta pancreáticas, como o demostra a primeira e segunda fase da resposta á insulina e a máxima actividade secretora das células beta. Estudos farmacodinámicos de pacientes con diabetes tipo 2 demostraron a restauración da primeira fase da secreción de insulina (administración intravenosa de insulina), a mellora da segunda fase da secreción de insulina (proba de clamp hiperglicémica) e a máxima actividade secretora da insulina (proba de estimulación da arginina).
Durante as terapias de 52 semanas con Viktoza ®, houbo unha mellora da función das células beta pancreáticas, como se evidencia na avaliación do modelo homeostático da función das células beta pancreáticas (índice HOMA) e da relación de insulina a proinsulina.
Secreción de glágono:
O liraglutido, estimulando a secreción de insulina e inhibindo a secreción de glucagón, reduce a concentración de glicosa no sangue. O liraglutido non inhibe a resposta do glucagón a baixas concentracións de glicosa. Ademais, no fondo do liraglutido, observouse unha menor produción de glicosa endóxena.
Baleirado gástrico:
O liraglutido provoca un lixeiro retraso no baleirado gástrico, reducindo así a intensidade da glicosa posprandial no sangue.
Peso corporal, composición corporal e gasto enerxético:
En suxeitos con aumento do peso corporal incluído en estudos clínicos a longo prazo de liraglutido, este último provocou unha diminución significativa do peso corporal. A dixitalización empregando métodos de tomografía computarizada (CT) e absorptiometría de raios X de dobre enerxía (DERA) demostrou que a perda de peso corporal produciuse principalmente debido á perda de tecido adiposo dos pacientes. Estes resultados explícanse polo feito de que durante a terapia con liraglutido en pacientes, a fame e o consumo de enerxía son reducidos.
Electrofisioloxía do corazón (Efc):
O estudo da liraglutida no proceso de repolarización no corazón foi probado nun estudo de EFS. O uso de liraglutido en concentración de equilibrio nunha dose diaria de ata 1,8 mg non produce prolongación de EPS.
Eficacia clínica
3992 pacientes con diabetes mellitus tipo 2 foron aleatorizados en 5 ensaios clínicos de dobre cego de seguridade e eficacia realizados para avaliar o efecto de Victoza ® sobre o control glicémico. A terapia Victoza ® produciu unha mellora clínica e estatisticamente significativa no HbA1sconcentración de glicosa en xaxún e posprandial en comparación co placebo.
Control glicémico
O medicamento Viktoza ® en forma de monoterapia durante 52 semanas causou unha estatística significativa (p ®), mentres que en pacientes que participaron en ensaios clínicos do uso combinado do medicamento Victoza ®, a media HbA1s diminuíu un 1,1-2,5%.
O medicamento Viktoza ® durante a terapia de combinación de 26 semanas con metformina, preparados de sulfonilurea ou metformina e tiazolidinedione causaron estatísticamente significativa (p ® e metformina, a adición de insulina detemir proporcionou unha maior eficiencia en comparación co medicamento Victoza ® e metformina despois de 26 semanas de tratamento (diminución HbA1c un 0,52%).
Demostrouse que a eficacia do medicamento Victoza ® nunha dose de 0,6 mg en combinación con sulfonilurea ou preparados de metformina é superior ao placebo, pero ao mesmo tempo menor que en doses de 1,2 mg e 1,8 mg.
A relación de pacientes que conseguiron unha diminución do HbA1s
No contexto da monoterapia con Viktoza ® durante un estudo de 52 semanas, o número de pacientes que lograron HbA1s ® en combinación con metformina, derivados da sulfonilurea ou unha combinación de metformina e tiazolidinione, o número de pacientes que alcanzaron o HbA1s ≤ 6,5%, estadísticamente significativa (p ≤ 0,0001) aumentou en relación ao número de pacientes que recibiron terapia só, sen a adición de Victoza ®, con medicamentos hipoglucémicos.
En grupos de pacientes que non lograron un control glicémico adecuado durante a terapia con Victoza ® e metformina, a porcentaxe de pacientes que alcanzaron o obxectivo HbA1s (® HbA acadado1s ® tanto en forma de monoterapia como en combinación con un ou dous axentes hipoglucémicos orais. Esta diminución observouse xa nas dúas primeiras semanas desde o inicio do tratamento.
Glicemia postprandial
O uso do medicamento Victoza ® durante tres días de tomar alimentos estándar contribuíu a reducir a concentración de glicosa posprandial nun 31-49 mg% (1,68-2,71 mmol / l).
Peso corporal
A monoterapia de 52 semanas con Viktoza ® asociouse con perda de peso sostida.
Durante todo o período do estudo clínico, a perda de peso sostida tamén se asociou ao uso de Victoza ® en combinación con metformina e en combinación con metformina e sulfonilureas ou unha combinación de metformina e tiazolidinedione.
Tamén se observou perda de peso en pacientes que recibían Victoza ® en combinación con metformina tras a adición de insulina detemir.
A maior diminución do peso corporal foi observada en pacientes que presentaron un maior índice de masa corporal (IMC) no punto de partida do estudo.
A monoterapia con Viktoza ® durante 52 semanas provocou unha diminución do volume medio de cintura en 3,0-3,6 cm.
Observouse unha diminución do peso corporal en todos os pacientes que recibiron terapia con Victoza ®, independentemente de se tiveron ou non unha reacción adversa en forma de náuseas.
O medicamento Viktoza ® como parte da terapia combinada con metformina reduciu o volume de graxa subcutánea nun 13-17%.
Steatohepatose non alcohólica
O liraglutido reduce a gravidade da steatohepatose en pacientes con diabetes tipo 2.
Presión arterial
Estudos clínicos a longo prazo demostraron que o medicamento Victoza ® reduce a presión arterial sistólica nunha media de 2,3-6,7 mm Hg. nas dúas primeiras semanas de tratamento. Unha diminución da presión arterial sistólica produciuse antes do inicio da perda de peso.
Outros datos clínicos
Nun estudo comparativo da eficacia e seguridade do medicamento Victoza ® (a doses de 1,2 mg e 1,8 mg) e o inhibidor da dipeptidil peptidase-4 sitagliptin a unha dose de 100 mg en pacientes que non lograron un control adecuado sobre a terapia con metformina, a mellor diminución foi probada despois de 26 semanas de tratamento. HbA1s ao usar o medicamento Victoza ® en ambas as doses en comparación coa sitagliptin (-1,24%, -1,50% en comparación con -0,90%, p ® en comparación con sitagliptin (43,7% e 56,0% por en comparación co 22,0%, p ® foi significativamente maior en comparación con pacientes que recibiron sitagliptin (-2,9 kg e -3,4 kg, en comparación con -1,0 kg, p ®, as náuseas foron máis comúns. Non obstante. as náuseas foron transitorias e a incidencia de hipoglucemia leve non foi significativamente diferente cando se tratou con Victoza ® e sitagliptin (0,178 e 0,161, fronte a 0,106 casos / paciente ao ano).1s e a vantaxe de Viktoza ® en comparación coa sitagliptina observouse despois da 26ª semana de tratamento con Viktoza ® (1,2 mg e 1,8 mg) e confirmouse despois da 52ª semana de tratamento (-1,29% e -1,51% en comparación co -0,88%, p ®, o que provocou unha diminución adicional e estatisticamente significativa do HbA1s na 78ª semana de tratamento (0,24% e 0,45%, 95 Cl: de 0,41 a 0,07 e de -0,67 a 0,23).
Nun estudo comparativo da eficacia e seguridade do fármaco Victoza ® (a unha dose de 1,8 mg) e exenatida (a unha dose de 10 μg dúas veces ao día) en pacientes que non lograron un control adecuado sobre a terapia con derivados de metformina e / ou sulfonilurea, despois de 26 semanas de uso do medicamento. Victoza ® observou unha maior diminución do HbA1s en comparación con exenatida (-1,12% en comparación con -0,79%, p ® en comparación con exenatida (54,2% en comparación con 43,4%, p = 0,0015). Ambas as terapias mostraron unha perda media peso corporal de aproximadamente 3 kg.O número de pacientes que informaban de náuseas foi menor no grupo de pacientes que recibían o medicamento Viktoza ®, en comparación con exenatida.A incidencia de hipoglucemia leve foi significativamente menor no grupo de pacientes que recibían o medicamento Viktoza ®, en comparación con exenatida ( 1 932 en comparación con 2 600 casos / paciente ao ano, p = 0,01) Despois de 26 semanas de administración de exenatida, os pacientes transferíronse a Victoza ®, o que provocou unha diminución adicional do HbA1s na 40ª semana de tratamento (-0,32%, p ® durante 52 semanas mellorou a sensibilidade á insulina en comparación coa dos preparados de sulfonilurea, que se revelou usando o modelo homeostático para avaliar a resistencia á insulina HOMA-IR.
Farmacocinética
Absorción
A absorción de liraglutido despois da administración subcutánea é lenta, o tempo para alcanzar a concentración plasmática máxima é de 8-12 horas despois da dose do medicamento. Concentración máxima (Cmáx) o liraglutido no plasma despois da inxección subcutánea nunha única dose de 0,6 mg é de 9,4 nmol / L. Coa introdución de liraglutido a unha dose de 1,8 mg, o indicador medio da súa concentración plasmática de equilibrio (AUC)?/24) alcanza aproximadamente 34 nmol / L. A exposición de liraglutido aumenta en proporción á dose administrada. Despois da administración de liraglutido nunha única dose, o coeficiente de variación de intrapopulación na área baixo a curva concentración-tempo de AUC é do 11%. A biodisponibilidade absoluta de liraglutido despois da administración subcutánea é aproximadamente do 55%.
Distribución
O volume aparente de distribución de liraglutido nos tecidos despois da administración subcutánea é de 11 a 17 litros. O volume medio de distribución de liraglutido despois da administración intravenosa é de 0,07 l / kg. O liraglutido únese en gran parte ás proteínas do plasma (> 98%).
Metabolismo
Durante 24 horas despois da administración a voluntarios sans dunha única dose do 3-liraglutido marcado co isótopo radioactivo, o principal compoñente plasmático mantívose inalterado. Detectáronse dous metabolitos do plasma (≤ 9% e ≤ 5% da radioactividade plasmática total). O liraglutido metabolízase de forma endóxena, do mesmo xeito que as proteínas grandes, sen implicar ningún órgano específico como vía excretora.
A cría
Despois de que se administrou unha dose de 3-liraglutido, non se detectou liraglutida modificada na urina ou nas feces. Só unha pequena fracción da radioactividade administrada en forma de metabolitos asociados a liraglutida (6% e 5%, respectivamente) foi excretada polos riles ou a través dos intestinos. As substancias radioactivas son excretadas polos riles ou polo intestino, principalmente durante os primeiros 6-8 días despois da dose do medicamento, e son tres metabolitos. A eliminación media do corpo despois da administración subcutánea de liraglutido nunha única dose é de aproximadamente 1,2 l / h cunha vida media de eliminación de aproximadamente 13 horas.
Grupos especiais de pacientes
A vellez: Os datos de estudos farmacocinéticos nun grupo de voluntarios saudables e a análise de datos farmacocinéticos obtidos nunha poboación de pacientes (de 18 a 80 anos) indican que a idade non ten un efecto clínicamente significativo sobre as propiedades farmacocinéticas de liraglutido.
Xénero: Unha análise farmacocinética baseada na poboación dos datos obtidos estudando o efecto da liraglutida en pacientes femininos e masculinos, e estudos farmacocinéticos nun grupo de voluntarios sans indican que o xénero non ten un efecto clínicamente significativo sobre as propiedades farmacocinéticas do liraglutido.
Etnia: Unha análise farmacocinética baseada na poboación dos datos obtidos no estudo dos efectos do liraglutido en suxeitos dos grupos raciais brancos, negros, asiáticos e latinoamericanos suxire que a etnia non ten un efecto clínicamente significativo sobre as propiedades farmacocinéticas do liraglutido.
Obesidade: Unha análise farmacocinética baseada na poboación dos datos suxire que o índice de masa corporal (IMC) non ten un efecto clínicamente significativo sobre as propiedades farmacocinéticas do liraglutido.
Insuficiencia hepática:
As propiedades farmacocinéticas do liraglutido estudáronse nun estudo clínico dunha única dose do fármaco en suxeitos con diferentes graos de insuficiencia hepática. No estudo incluíronse pacientes con insuficiencia hepática leve (segundo a clasificación Child Pugh, a gravidade da enfermidade de 5 - 6 puntos) e insuficiencia hepática grave (segundo a clasificación Child Pugh, a gravidade da enfermidade> 9 puntos). A exposición de liraglutido no grupo de pacientes con función hepática alterada non foi superior á do grupo de suxeitos saudables, o que indica que a insuficiencia hepática non ten un efecto clínicamente significativo na farmacocinética de liraglutida.
Insuficiencia renal:
A farmacocinética de liraglutido estudouse en pacientes con diferentes graos de insuficiencia renal nun estudo de única dose. Este estudo incluíu suxeitos con diferentes graos de insuficiencia renal: desde leves (avaliación da depuración da creatinina de 50-80 ml / min) a severas (non se realizou a avaliación da depuración da creatinina ® en nenos.
Datos do estudo preclínico de seguridade
Os resultados de estudos toxicolóxicos preclínicos coa introdución de doses repetidas de fármaco, incluída a xenotoxicidade, demostraron que o uso de liraglutida non representa unha ameaza para a saúde humana.
Identificáronse tumores de células C tiroides en ratas e ratos durante estudos de dous anos sobre a carcinoxenicidade do fármaco en roedores e non levaron á morte. Non se estableceu unha dose non tóxica (NOAEL) nas ratas. Non se observou a aparición de tales tumores en monos tratados con liraglutido durante 20 meses. Os resultados obtidos en estudos sobre roedores están asociados a que os roedores son particularmente sensibles ao mecanismo específico non xenotóxico mediado polo receptor GLP-1. A importancia dos datos obtidos para os humanos é baixa, pero non se pode excluír completamente. Non se observou a aparición doutras neoplasias asociadas á terapia.
Os estudos realizados en animais non revelaron un efecto adverso directo do fármaco na fertilidade, pero houbo un lixeiro aumento na frecuencia da morte precoz dos embrións durante o tratamento coa maior dose. A introdución do medicamento Viktoza ® ás ratas no medio do embarazo provocou que reduciran o peso corporal da nai e o crecemento dos embriones cun efecto incompletamente estudado nas costelas e desviacións na estrutura esquelética no grupo de coellos. O crecemento dos recentemente nados no grupo de ratos diminuíu durante a terapia con Victoza ® e esta diminución persistiu despois da lactación no grupo de modelos que recibiron altas doses de liraglutida. Non se sabe o que provocou tal diminución no crecemento das ratas recentemente nadas: unha diminución do consumo de leite materno debido á influencia directa do GLP-1, ou a unha produción insuficiente de leite materno por ratas maternas debido a unha diminución do consumo de calorías.
Forma de dosificación
Solución subcutánea 6 mg / ml
Contén 1 ml de solución
substancia activa - liraglutida 6 mg,
excipientes: hidróxido de fosfato sódico dihidrato, propilenglicol, fenol, ácido clorhídrico (solución 2M) / hidróxido sódico (solución 2M), auga para a inxección.
Solución incolora ou case incolora, practicamente libre de impurezas mecánicas.
Dosificación e administración
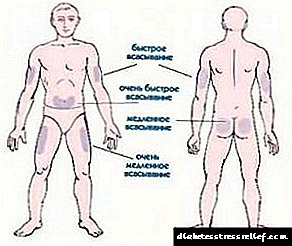
O medicamento Viktoza® úsase unha vez ao día en calquera momento, independentemente da inxestión de alimentos, pódese administrar como unha inxección subcutánea no abdome, a coxa ou o ombreiro. O lugar ea hora da inxección poden variar sen axustar a dose. Non obstante, é preferible tomar a droga aproximadamente á mesma hora do día, no momento máis conveniente para o paciente. Máis información sobre o método de uso do medicamento Viktoza® pode atoparse na sección para uso e eliminación. O medicamento Viktoza® non se pode usar para a administración intravenosa e intramuscular.
A dose inicial de Victoza® é de 0,6 mg por día. Despois de usar o medicamento durante polo menos unha semana, a dose debería aumentarse ata 1,2 mg. Hai evidencias de que nalgúns pacientes, o beneficio do tratamento aumenta cun aumento da dose do medicamento de 1,2 mg a 1,8 mg. Para conseguir o mellor control glicémico nun paciente e tendo en conta a eficacia clínica, a dose de Viktoza® pode aumentar ata 1,8 mg despois de usalo a unha dose de 1,2 mg durante polo menos unha semana. Non se recomenda o uso do medicamento nunha dose diaria superior a 1,8 mg.
O medicamento Victoza® pode usarse como complemento á terapia existente con metformina ou terapia combinada con metformina e tiazolidinione. A terapia con metformina en combinación con tiazolidinione pode continuar nas doses actuais.
Victoza® pode usarse como complemento durante a terapia con sulfonilurea existente ou en terapia combinada con metformina e sulfonilurea ou insulina basal. Cando Viktoza® se engade á sulfonilurea ou á insulina terapéutica basal, debe considerarse a redución da dose de sulfonilurea ou insulina basal co fin de minimizar o risco de hipoglucemia non desexada (ver sección "Instrucións especiais").
Para axustar a dose de Victoza®, non é necesario autocontrol da glicosa no sangue. Non obstante, ao comezo da terapia con Viktoza® en combinación con derivados da sulfonilurea ou con insulina basal, pode ser necesaria tal auto-monitoreo da glicosa en sangue para axustar a dose de preparados de sulfonilurea.
Grupos especiais de pacientes
Maiores (> 65 anos): non se precisa selección de dose segundo a idade. Existe unha experiencia limitada no uso do medicamento en pacientes de 75 anos e máis (ver sección "Farmacocinética").
Pacientes con insuficiencia renal
Non é necesario axustar a dose no tratamento de pacientes con forma leve de insuficiencia renal (limpieza de creatinina 60 - 90 ml / min). Só hai unha experiencia moi limitada no tratamento de pacientes con insuficiencia renal moderada (limpieza de creatinina entre 30 e 59 ml / min) e non hai datos sobre o tratamento de pacientes con insuficiencia renal grave (limpieza de creatinina por baixo de 30 ml / min). Na actualidade, Victoza non está recomendado para o uso por pacientes con formas graves ou moderadas de insuficiencia renal, incluídos os pacientes en estadio terminal da enfermidade renal (ver sección farmacocinética)
Pacientes con alteración da función hepática
A experiencia de tratar pacientes con todas as formas de insuficiencia hepática (leve, moderada e grave) actualmente é demasiado limitada para recomendar o uso de Victoza (ver sección farmacocinética).
Poboación de pacientes pediátricos
A droga Victoza non está recomendada para nenos e adolescentes menores de 18 anos debido á falta de datos sobre a seguridade e eficacia do seu uso.
Efectos secundarios
Nos ensaios clínicos, os efectos secundarios máis frecuentemente reportados do tracto gastrointestinal: náuseas e diarrea (rexistrado en> 10% dos pacientes), vómitos, estreñimiento, dor abdominal e síntomas dispépticos (rexistrados en ≥ 1%, pero ≤ 10 % de pacientes).
Ao comezo da terapia con Viktoza®, estes efectos secundarios gastrointestinais poden producirse con máis frecuencia, pero a medida que o tratamento continúa, as reaccións adoitan diminuír ao longo de varios días ou semanas. As reaccións adversas en forma de dores de cabeza e infeccións das vías respiratorias superiores foron observadas relativamente a miúdo (1-10% dos pacientes). Ademais, é posible o desenvolvemento de condicións hipoglucémicas, especialmente cando se usa o medicamento Victoza® en combinación con derivados da sulfonilurea (rexistrado en> 10% dos pacientes). A hipoglucemia grave se produce principalmente no fondo do uso combinado do medicamento Viktoza® con sulfonilureas.
Raramente se informaron de efectos secundarios graves.
Descrición das reaccións adversas individuais
Nun estudo clínico que usa o liraglutido como monoterapia, a incidencia de hipoglucemia con liraglutida foi inferior á incidencia de hipoglucemia en pacientes tratados co medicamento de referencia (glimepirida). As reaccións adversas máis comúns inclúen enfermidades gastrointestinais, infeccións e infestacións.
A maioría dos episodios de hipoglucemia confirmada nos ensaios clínicos foron insignificantes. Nun estudo que usa o liraglutido como monoterapia, non houbo casos graves de hipoglucemia. Os episodios graves de hipoglucemia non son comúns e inicialmente foron observados co uso de liraglutida en combinación con sulfonilurea (0,02 episodios por ano de paciente). Observouse un número moi reducido de episodios (0,001 episodios por ano de paciente) coa administración de liraglutido en combinación con axentes antidiabéticos orais distintos da sulfonilurea. O risco de hipoglucemia é baixo co uso combinado de insulina basal e liraglutido (1,0 episodio por ano de paciente, ver sección farmacodinámica).
Reaccións adversas gastrointestinais
Cando se combinaron liraglutida e metformina, o 20,7% dos pacientes informou polo menos un episodio de náuseas e o 12,6% dos pacientes informaron polo menos un episodio de diarrea.
Cando o liraglutido se combinou con sulfonilurea, o 9,1% dos pacientes informou polo menos un episodio de náuseas e o 7,9% dos pacientes informaron polo menos un episodio de diarrea. A maioría dos efectos secundarios foron de natureza leve ou moderada e tiñan unha natureza dependente da dose.
Cun tratamento prolongado, a frecuencia e a gravidade diminuíron na maioría dos pacientes que presentaban náuseas no estadio inicial.
En pacientes maiores de 70 anos, cando se trata con liraglutido, poden producirse máis frecuentemente trastornos gastrointestinais.
En pacientes con insuficiencia renal leve ou moderada (liberación de creatinina de 60-90 ml / min e 30-59 ml / min, respectivamente), poden producirse máis reaccións laterais gastrointestinais durante o tratamento con liraglutida.
Exclusión de pacientes de probas
Nos ensaios controlados a longo prazo (26 semanas ou máis), a proporción de pacientes excluídos da proba por reaccións adversas foi do 7,8% para os pacientes sometidos a tratamento con liraglutida e do 3,4% para os pacientes do grupo de tratamento de comparación. As reaccións adversas máis comúns que levaron á retirada do ensaio no tratamento de pacientes con liraglutida inclúen náuseas (2,8% dos pacientes) e vómitos (1,5% dos pacientes).
Reaccións no lugar da inxección
En aproximadamente o 2% dos pacientes informouse dunha reacción no lugar de inxección do medicamento ao longo dos ensaios clínicos controlados a longo prazo de Victoza (26 semanas ou máis). Estas reaccións normalmente eran menores.
Ao longo de longos ensaios clínicos controlados con Victoza (26 semanas ou máis), houbo informes de varios casos de pancreatite aguda (
Contraindicacións
- Hipersensibilidade á substancia activa ou outra
os compoñentes que compoñen a droga
- uso en pacientes con diabetes tipo 1
- para o tratamento da cetoacidosis diabética
insuficiencia renal e hepática grave
- idade infantil e adolescente ata 18 anos
- embarazo e lactación
Interaccións farmacéuticas
Avaliación da interacción con drogas in vitro
O liraglutido mostrou unha baixa capacidade para a interacción farmacocinética dos fármacos debido ao metabolismo no sistema citocromo P-450 (CYP), ademais de unirse ás proteínas do plasma.
Avaliación de interacción con drogas in vivo
Un lixeiro retraso no baleirado gástrico cando se usa liraglutido pode afectar á absorción de medicamentos concomitantes destinados á administración oral. Os estudos sobre interacción con drogas non demostraron ningunha desaceleración clínica significativa na absorción destes fármacos. Varios pacientes tratados con Victoza® tiveron polo menos un episodio de diarrea aguda. A diarrea pode afectar a absorción de medicamentos orais que se usan simultaneamente con Victoza®.
Warfarina e outros derivados da cumarina
Non se realizaron estudos sobre a interacción dos dous fármacos. Ao comezo do tratamento con Victoza® en pacientes que reciben warfarina ou outros derivados de cumarina, recoméndase controlar con máis frecuencia o INR (relación normalizada internacional).
A liraglutida non provocou un cambio na acción xeral do paracetamol despois da súa administración nunha única dose de 1000 mg. A concentración máxima de paracetamol no plasma (Cmax) diminuíu un 31% e o tempo medio para alcanzar un pico na súa concentración (tmax) no plasma sanguíneo estendeuse en 15 minutos. Coa administración simultánea de liraglutido e paracetamol, non se precisa axuste da dose deste último.
A liraglutida non causou un cambio clínicamente significativo no efecto xeral da atorvastatina despois da súa administración nunha única dose de 40 mg. Así, non se precisa axuste da dose de atorvastatina mentres se toma Victoza®. A concentración plasmática máxima de atorvastatina (Cmax) diminuíu un 38%, e o tempo medio para alcanzar un pico na concentración plasmática (tmax) en pacientes que recibiron liraglutida alargouse dunha a tres horas.
A liraglutida non causou un cambio no efecto xeral da griseofulvin despois da súa administración nunha única dose de 500 mg. A concentración máxima de griseofulvina (Cmax) aumentou un 37%, mentres que o tempo medio para alcanzar a súa concentración máxima (tmax) no plasma non cambiou. Non é necesario axustar a dose de griseofulvin e outros medicamentos de baixa solubilidade e alta permeabilidade.
A introdución de digoxina nunha única dose de 1 mg co uso de liraglutida mostrou unha diminución da área baixo a curva (AUC) da digoxina nun 16%, a concentración máxima de plasma (Cmax) de digoxina diminuíu un 31%. O tempo medio para alcanzar a concentración máxima (tmax) de digoxina mentres tomaba liraglutido aumentou dunha hora e media. Con base nos resultados obtidos, non se precisa axuste da dose de digoxina mentres se toma liraglutido.
A administración de lisinopril nunha única dose de 20 mg ao usar liraglutida mostrou unha diminución da área baixo a curva (AUC) de lisinopril nun 15%, a concentración máxima de plasma (Cmax) de lisinopril diminuíu un 27%. O tempo medio para alcanzar a concentración máxima (tmax) de lisinopril no plasma ao tomar liraglutido aumentou de seis a oito horas. Con base nos resultados, non se precisa un axuste da dose de lisinopril e digoxina mentres toma liraglutido.
A concentración plasmática máxima (Cmax) de etinilestradiol e levonorgestrel en dose única durante a terapia con liraglutido diminuíu un 12% e un 13%, respectivamente. Nas mesmas condicións, o tempo medio para alcanzar a concentración máxima (tmax) destes fármacos foi 1,5 horas máis tarde do habitual. O efecto clínicamente significativo sobre o efecto global do etinilestradiol e levonorgestrel no corpo non ten liraglutido. Así, o efecto anticonceptivo previsto de ambos os dous fármacos durante a terapia con liraglutido non cambia.
Non se detectou ningunha interacción farmacocinética ou farmacodinámica de liraglutido con insulina detemir cun único uso de insulina detemir a unha dose de 0,5 U / kg con liraglutido a unha dose de 1,8 mg en pacientes con diabetes mellitus tipo 2.
As substancias engadidas a Victoza® poden causar a degradación do liraglutido. Como non se realizaron probas de compatibilidade, Viktoza® non se pode mesturar con outros fármacos, incluídas solucións de infusión.
Instrucións especiais
Victoza® non se debe usar en pacientes con diabetes mellitus tipo 1 nin para o tratamento da cetoacidosis diabética.
Victoza® non substitúe a insulina.
A experiencia de usar Victoza® en pacientes con insuficiencia cardíaca de clases funcionais I-II de acordo coa Clasificación funcional da insuficiencia cardíaca crónica (CHF) da New York Cardiac Association (NYHA) é limitada e polo tanto o liraglutido debe usarse con precaución en tales pacientes. Non hai experiencia no tratamento de pacientes con insuficiencia cardíaca conxestiva de clase III-IV segundo a clasificación NYHA e, polo tanto, non se recomenda o nomeamento de liraglutido en tales pacientes.
Os datos sobre o uso do medicamento Viktoza® en pacientes con enfermidade inflamatoria intestinal e pareses diabéticas do estómago son limitados, non se recomenda o uso do medicamento Viktoza® nestes grupos de pacientes. O uso do medicamento Viktoza® está asociado ao desenvolvemento de reaccións adversas a curto prazo do tracto gastrointestinal, como náuseas, vómitos e diarrea.
O uso doutros agonistas de GLP-1 asociouse cun risco de desenvolver pancreatite. Informáronse de varios casos de pancreatite aguda. Os pacientes deben informarse sobre os síntomas característicos do desenvolvemento da pancreatite aguda: dor severa persistente no abdome. Se se sospeita pancreatite, a terapia con Victoza® e outros medicamentos potencialmente perigosos deberían deterse inmediatamente.
Cando se confirma o diagnóstico de pancreatite aguda, non se debe continuar o uso do medicamento Viktoza®. Débese ter precaución ao prescribir o medicamento a pacientes con antecedentes de pancreatite.
Enfermidade da tiroides
Durante ensaios clínicos do medicamento Victoza®, informáronse efectos secundarios da tiroides, incluída a calcitonina sérica elevada, o bocio tireotóxico difuso e as neoplasias tiroideas, polo tanto o liraglutido debe usarse con precaución, especialmente en pacientes con enfermidades preexistentes glándula tiroides (ver sección "Efectos secundarios").
Os pacientes que toman liraglutido en combinación con sulfonilurea ou insulina basal poden ter un maior risco de hipoglucemia (ver sección "Efectos secundarios"). O risco de hipoglucemia pode reducirse reducindo a dose de sulfonilurea ou insulina basal.
Describíronse signos e síntomas da deshidratación, incluída a función renal deteriorada e a insuficiencia renal aguda en pacientes que toman liraglutido. Os pacientes que toman liraglutido deben ser avisados do posible risco de deshidratación en función dos efectos secundarios do tracto gastrointestinal e recomendar que se tomen precaucións para evitar o esgotamento do fluído no corpo.
Datos do estudo preclínico de seguridade
Os resultados dos estudos preclínicos, baseados en estudos xeralmente aceptados de seguridade farmacolóxica, toxicidade con doses repetidas do medicamento e xenotoxicidade, demostraron que o uso de liraglutida non representa unha ameaza para a saúde humana.
Os neoplasmas das células C e ratos da glándula tiroides da rata foron detectados durante ensaios de dous anos da oncoxenicidade do fármaco en roedores e non levaron á morte. Non se observou evidencia de efectos secundarios adversos (NOAEL) nos ratos. Non se observou a aparición de tales neoplasias en monos tratados con liraglutida durante 20 meses. Os resultados obtidos nas probas sobre roedores están asociados a que os roedores son particularmente sensibles ao péptido -1 (GLP-1) similar ao glucagón mediado por un receptor dun mecanismo específico non xenotóxico. A relevancia dos datos obtidos para os humanos é baixa, pero non se pode excluír completamente. Non se observou a aparición doutras neoplasias asociadas á terapia.
Nos estudos realizados en animais, non houbo ningún efecto adverso directo do fármaco sobre a fertilidade, pero houbo un lixeiro aumento na frecuencia de morte precoz dos embrións durante o tratamento coa maior dose. A introdución do medicamento Viktoza ás ratas no medio do período de xestación provocou que reduciran o peso corporal da nai e o crecemento do embrión co efecto sobre as costelas non comprendidas e as desviacións da estrutura esquelética no grupo de coellos. O crecemento de recentemente nados no grupo de ratas durante a terapia con Victoza diminuíu e esta diminución mantívose persistentemente no período posterior á lactación no grupo de modelos que recibían altas doses de liraglutido. Non se sabe o que provocou tal diminución no crecemento de ratas recentemente nadas: unha diminución no consumo de leite materno debido á influencia directa do péptido GLP-1 como glucagón ou a unha produción insuficiente de leite materno por ratas maternas debido a unha diminución do consumo de calorías.
Tras a inxección intraarterial de liraglutido en coellos, observáronse hemorraxias de leve a moderada, vermelhidão e inchazo no lugar da inxección.
Uso durante o embarazo e durante a lactación
Os estudos realizados en animais non revelaron un efecto adverso directo do fármaco na fertilidade, pero houbo un lixeiro aumento na frecuencia da morte precoz dos embrións durante o tratamento coa maior dose. A administración de Viktoza® ás ratas no medio do embarazo provocou unha redución do peso corporal da nai e o crecemento dos embriones cun efecto incompletamente estudado nas costelas e desviacións na estrutura do esqueleto no grupo de coellos. O crecemento de individuos recentemente nados no grupo de ratos durante a terapia con Victoza® diminuíu e esta diminución persistiu despois da lactación no grupo de individuos que recibían altas doses de liraglutido. Non se sabe o que provocou tal diminución no crecemento das ratas recentemente nadas: unha diminución do consumo de leite materno debido á influencia directa do GLP-1, ou a un nivel insuficiente de produción de leite materno por ratas maternas debido a unha diminución do consumo de calorías.
Non hai datos adecuados sobre o uso do medicamento Victoza® en mulleres embarazadas. Descoñécese o risco potencial para os humanos.
O medicamento Viktoza® non se pode usar durante o embarazo, en cambio, recoméndase realizar un tratamento con insulina. Se o paciente se prepara para o embarazo ou xa comezou o embarazo, a terapia con Victoza® debería deterse inmediatamente.
Non hai experiencia co uso do medicamento Victoza® en mulleres que amamantan, o uso do medicamento durante a lactación está contraindicado.
Características do efecto da droga na capacidade para conducir vehículos e mecanismos potencialmente perigosos
Non se realizou un estudo sobre o efecto da droga Victoza® sobre a capacidade de conducir vehículos e traballar con mecanismos. Os pacientes deben advertirse de que deben tomar precaucións para evitar o desenvolvemento dun estado de hipoglucemia durante a condución e cando se traballan con mecanismos, especialmente se se toma Victoza® como parte da terapia combinada con sulfonilureas ou con insulina basal.
Sobredose
Síntomas: durante un ensaio clínico con Victoza®, un dos pacientes con diabetes tipo 2 sufriu unha sobredose do medicamento en forma de inxección subcutánea a unha dose de 72 mg (40 veces a dose máxima recomendada de 1,8 mg). A sobredose provocou náuseas e vómitos graves. Non se observou hipoglucemia. O paciente recuperouse completamente sen complicacións.
Tratamento: recoméndase unha terapia sintomática adecuada, segundo os signos e síntomas clínicos.
Farmacodinámica
O liraglutido é un análogo do GLP-1 humano (péptido-1 como glucagón). Producido polo método biotecnolóxico do ADN recombinante (ácido desoxirribonucleico) utilizando a cepa Saccharomyces cerevisiae, que ten un 97% de homoloxía co GLP-1 humano, une e activa os receptores do GLP-1 en humanos.
O receptor GLP-1 é un branco para o GLP-1 nativo, que é unha hormona endóxena da incretina, que estimula a secreción de insulina dependente da glicosa nas células β pancreáticas. En comparación co GLP-1 nativo, os perfís farmacodinámicos e farmacocinéticos de liraglutida permiten administralo unha vez ao día.
Con inxección subcutánea, o perfil de acción prolongada baséase en tres mecanismos:
- auto-asociación, que proporciona unha absorción demorada de liraglutido,
- ligante á albumina,
- maior nivel de estabilidade enzimática fronte a DPP-4 (dipeptidil peptidase-4) e NEP (endopeptidasa neutral da enzima), o que asegura unha longa T1/2 (vida media) dunha sustancia procedente do plasma.
O efecto do liraglutido está baseado na interacción con receptores específicos de GLP-1, como resultado do cal aumenta o nivel de cAMP (monofosfato de adenosina cíclica). Baixo a acción da sustancia, obsérvase a estimulación dependente da glicosa da secreción de insulina e a función das células β pancreáticas mellora. Ao mesmo tempo, prodúcese a supresión dependente da glicosa da secreción excesivamente aumentada de glucagón. Así, cun aumento da concentración de glicosa no sangue, suprímese a secreción de glucagón e estimúlase a secreción de insulina.
Por outra banda, en pacientes con hipoglucemia, o liraglutido reduce a secreción de insulina sen inhibir a secreción de glucagón. O mecanismo para reducir a glicemia tamén inclúe un lixeiro atraso no baleirado gástrico. Usando mecanismos que provocan unha diminución da fame e unha diminución do gasto enerxético, o liraglutido conduce a unha diminución do tecido adiposo e a perda de peso.
O GLP-1 é un regulador fisiolóxico do apetito e o consumo de calorías, os receptores deste péptido están localizados en varias áreas do cerebro que están implicadas na regulación do apetito.
Ao realizar estudos con animais, comprobouse que mediante a activación específica dos receptores GLP-1, o liraglutido aumenta os sinais de saturación e debilita os sinais de fame, dando lugar a perda de peso.
Ademais, segundo estudos realizados en animais, o liraglutido retarda o desenvolvemento da diabetes. A sustancia é un poderoso factor para a estimulación específica da proliferación de células β pancreáticas e prevén a morte de células β (apoptose), que é inducida por citocinas e ácidos graxos libres. Así, o liraglutido aumenta a biosíntese de insulina e aumenta a masa das células β. Despois de normalizar a concentración de glicosa, o liraglutido deixa de aumentar a masa de células β pancreáticas.
A vitosa ten un longo efecto de 24 horas e mellora o control glicémico, que se logra reducindo a concentración de glicosa en sangue en xaxún e despois de comer con diabetes tipo 2.
Grupo farmacolóxico
Outros medicamentos hipoglucémicos, con excepción da insulina.
Código ATC A10V X07.
Victoza® úsase para tratar a diabetes mellitus tipo II en adultos co fin de lograr o control glicémico en combinación con:
- metformina ou sulfonilurea en pacientes con mal control glicémico, a pesar da utilización das doses máximas toleradas de metformina ou sulfonilurea como monoterapia,
- metformina e sulfonilureas, ou metformina e tiazolidinediones en pacientes con mal control glicémico a pesar da dobre terapia.
A terapia combinada con insulina basal en pacientes que non lograron un control glicémico adecuado coa axuda de Viktoza e metformina.
Reaccións adversas
En cinco ensaios clínicos de longa duración, máis de 2500 pacientes recibiron Victoza® só ou a súa combinación con metformina, con glimepirida (con ou sen metformina), sulfonilurea (con ou sen metformina), ou con metformina + rosiglitazona.
A avaliación da incidencia dos efectos secundarios realizouse na seguinte escala: moi a miúdo
(≥ 1/10), a miúdo (de ≥ 1/100 a ® - 2501). Preséntanse as seguintes reaccións adversas, cuxa incidencia no grupo de pacientes que recibían o medicamento Viktoza® superou en máis dun 5% a frecuencia no grupo onde recibiron o medicamento de comparación. Tamén se inclúen reaccións adversas, cuxa incidencia é ³1%, pero ocorren máis de dúas veces máis veces en comparación co medicamento de comparación.
Trastornos metabólicos e nutricionais: a miúdo - hipoglucemia, anorexia, diminución do apetito con pouca frecuencia - deshidratación *.
Trastornos do sistema nervioso: moitas veces - dor de cabeza, mareos.
Trastornos dixestivos: moi a miúdo - náuseas, diarrea, a miúdo - vómitos, dispepsia, dor no abdome superior, estreñimiento, gastrite, flatulencia, balonción, enfermidade de refluxo gastroesofágico, eructos, dentes de dentes, gastroenterite viral moi raramente - (pancreatite (incluída necrótica) pancreatite).
Trastornos cardiovasculares: moitas veces - aumento da frecuencia cardíaca (HR).
Trastornos do sistema inmune: raramente reaccións anafilácticas.
Infeccións e infestacións: a miúdo - infeccións das vías respiratorias superiores (nasofaringitis, bronquite).
Trastornos xerais e estado do lugar da inxección: raramente - malestar, a miúdo - fatiga, febre, reaccións no lugar da inxección.
Trastornos nos riles e nas vías urinarias : con pouca frecuencia - insuficiencia renal aguda *, alteración da función renal *.
Por parte da pel e do tecido subcutáneo : a miúdo - erupción cutánea, raramente - urticaria, picazón.
(* Vexa a sección Características de aplicación).
Descrición das reaccións adversas individuais
Durante un ensaio clínico de monoterapia con Viktoza®, a incidencia de hipoglucemia en pacientes que toman Victoza® foi menor que en pacientes que recibían o medicamento de referencia activa (glimepirida). As reaccións adversas máis comúns foron trastornos gastrointestinais, infeccións e infestacións.
Na maioría dos casos rexistrados durante ensaios clínicos, a hipoglucemia confirmada foi insignificante. Durante a monoterapia con Viktoza®, non houbo un único caso de hipoglucemia grave. A hipoglicemia grave ocorre raramente e obsérvase principalmente cun tratamento combinado con Viktoza® e sulfonilurea (0,02 casos / anos pacientes). Moi raramente (0,001 casos / anos pacientes) houbo casos de hipoglucemia durante o tratamento con Victoza® en combinación con outros antidiabéticos orais (é dicir, non con sulfonilurea).
Despois da administración adicional de insulina a pacientes detemir, recibiron liraglutida 1,8 mg de metformina; non houbo casos de hipoglucemia grave. A incidencia de hipoglucemia leve foi de 0,286 casos por paciente-ano. Nos grupos de comparación, a incidencia de hipoglucemia leve foi de 0,029 casos por paciente ao ano no tratamento con liraglutida
1,8 mg e 0,129 casos por paciente-ano con tratamento con metformina.
Trastornos dixestivos
A maioría dos casos de náuseas foron leves ou moderadas, temporais e raramente levaron á retirada da terapia.
Con tratamento combinado con Victoza® e metformina, as náuseas ocorreron polo menos unha vez no 20,7% dos pacientes, e a diarrea no 12,6% dos pacientes. Cando se combina con Viktoza® e sulfonilurea, as náuseas ocorreron polo menos unha vez no 9,1% dos pacientes, e a diarrea no 7,9%. A maioría dos casos eran de gravidade leve ou moderada e dependían da dose.
En pacientes maiores de 70 anos, poden producirse trastornos do sistema dixestivo co tratamento con Victoza®.
En pacientes con insuficiencia renal leve (liberación da creatinina de £ 60-90 ml / min), poden aparecer máis frecuentemente trastornos do sistema dixestivo co tratamento con Viktoza®.
Retirada de drogas
Durante os ensaios controlados a longo prazo (26 semanas ou máis), a frecuencia de retirada do medicamento Viktoza® debido ás reaccións adversas ocorridas foi do 7,8% e a retirada do medicamento de comparación foi do 3,4%. A causa máis común disto en pacientes que recibían Victoza® foi náuseas (2,8%) e vómitos (1,5%).
Debido ás posibles propiedades inmunoxénicas de fármacos que conteñen proteínas ou péptidos, pódense formar anticorpos anti-liraglutidn en pacientes tratados con Victoza®. Atopáronse nunha media do 8,6% dos pacientes. A formación de anticorpos non se asociaba a unha diminución da eficacia de Victoza®.
Reaccións no sitio de inxección
Durante ensaios controlados a longo prazo (26 semanas ou máis), informáronse reaccións no lugar da inxección de Viktoza® en aproximadamente o 2% dos pacientes. Estas reaccións normalmente eran leves.
No curso de longos ensaios clínicos, informáronse varios casos durante o tratamento con Viktoza® (® non foi establecido nin excluído.
Disfunción da tiroides
A incidencia total da disfunción da tiroide durante todos os estudos (mediano e longo) foi de 33,5, 30,0 e 21,7 casos por cada 1000 pacientes anos de exposición total de liraglutidas, placebo e medicamentos de comparación, con 5,4. , Respectivamente, atribuíronse 2,1 e 0,8 casos a reaccións adversas graves.
En pacientes tratados con Victoza®, os tumores de tiroides aumentaron os niveis de calcitonina no sangue e o bocio foi máis frecuente.
Despois do lanzamento de Victoza® no mercado, informáronse reaccións alérxicas, incluída urticaria, erupción e prurito. Tamén se informaron varios casos de reaccións anafilácticas con síntomas adicionais como hipotensión, palpitaciones, dispnea e edema.
Uso durante o embarazo e a lactación
Non hai datos adecuados sobre o uso do medicamento Viktoza® por mulleres embarazadas. Os estudos en animais demostraron toxicidade reprodutiva (ver sección "Datos preclínicos de seguridade"). Descoñécese o risco potencial para os humanos.
O medicamento Viktoza® non debe ser usado durante o embarazo, recoméndase prescribir insulina no seu lugar. Se o paciente quere quedar embarazada ou embarazada, entón o medicamento Victoza ® debe ser interrompido.
Período de lactación
Non se sabe se o liraglutido se excreta no leite materno. Os estudos en animais demostraron que cantidades insignificantes de liraglutidos e os seus metabolitos estruturais estreitamente relacionados entra no leite. Por experiencia insuficiente durante a lactación, non se debe usar o medicamento Viktoza®.
Debido á falta de datos, Victoza® non está recomendado para nenos.
Características da aplicación
Victoza® non se usa para tratar pacientes con diabetes mellitus tipo 1 ou cetoacidosis diabética.
Viktoza® non é un substituto da insulina.
A eficacia da inxestión adicional de liraglutido en pacientes que xa están sendo tratados con insulina e non foron avaliados.
A experiencia de tratar pacientes con insuficiencia cardíaca conxestiva de clases I-II (segundo a clasificación da Asociación de Cardioloxía de Nova York - NYHA) é limitada, e non hai datos sobre o tratamento de pacientes con insuficiencia cardíaca conxestiva de clases III-IV.
Por experiencia limitada, non se recomenda prescribir a droga Viktoza® a pacientes con enfermidades inflamatorias intestinais e gastroparesis diabética.
O uso doutros análogos de GLP-1 está asociado a un risco de desenvolver pancreatite. Hai varios informes de pancreatite aguda. Os pacientes deben ser informados sobre os síntomas característicos da pancreatite aguda (dor persistente e grave na cavidade abdominal). Se se sospeita pancreatite, debería interromperse o tratamento con Viktoza® e outros medicamentos provocadores.
Durante os ensaios clínicos, as reaccións adversas notadas da glándula tiroide son un aumento do nivel de calcitonina no sangue, bocio e tumor, especialmente en pacientes con enfermidades da tiroides (ver sección "Reaccións adversas").
Os pacientes tratados con Victoza® presentaron síntomas de deshidratación, incluída a función renal deteriorada e insuficiencia renal aguda.
Os pacientes destinados a Victoza® deben ser advertidos sobre a posibilidade de deshidratación debido a trastornos do sistema dixestivo e a necesidade de tomar medidas de precaución para a deshidratación.
En pacientes que reciben o medicamento Viktoza® simultaneamente con sulfonilurea, aumenta o risco de desenvolver hipoglucemia (ver sección "Reaccións adversas"). O risco de hipoglucemia pode reducirse reducindo a dose de sulfonilurea.
A capacidade de influencia da velocidade de reacción ao conducir vehículos ou outros mecanismos
Non se realizaron estudos sobre o efecto da droga Victoza® sobre a capacidade de conducir vehículos e outros mecanismos. Debe aconsellar aos pacientes que adopten medidas para evitar a aparición de hipoglucemia durante o período de condución dun vehículo ou outro mecanismo, en particular cando usen o medicamento Viktoza® simultaneamente coa sulfonilurea.
Interacción con outras drogas e outro tipo de interaccións .
In vitro o liraglutido mostrou un potencial moi baixo para a farmacocinética doutras substancias activas, cuxo intercambio está asociado ao citocromo 450 así como a unión a proteínas plasmáticas.
O liraglutido provoca un lixeiro retraso no baleirado gástrico e pode afectar a absorción dos medicamentos usados simultaneamente no interior.
A liraglutida non cambiou a exposición total de paracetamol despois dunha única dose de 1000 mg. A concentración máxima de paracetamol (C máx ) diminuíu un 31% e o tempo para alcanzar a concentración máxima (t máx ) aumentou a 15 minutos. Co uso simultáneo de paracetamol, non se precisa axuste da dose.
Atorvastatina A liraglutida non cambiou a exposición total á atorvastatina dun nivel clínicamente significativo despois dunha única dose dela a unha dose de 40 mg. Neste sentido, non é necesario o uso simultáneo de Viktozoy® axuste da dose de atorvastatina. Administrado co liraglutido C máx a atorvastatina diminuíu un 38% e t máx aumentou de 1:00 a 3:00.
Griseofulvin A liraglutida non cambiou a exposición total de griseofulvin despois dunha única dose de 500 mg. C máx aumentou un 37%, mentres que t máx non cambiou. Non é necesario axustar a dose cando se usa griseofulvin e outros compostos de raíz baixa con alta permeabilidade.
Lisinopril e digoxina
Despois dunha única inxección de 20 mg de lisinopril ou 1 mg de digoxina en combinación con liraglutido, notouse unha diminución da área baixo a curva de concentración-tempo (AUC) destes fármacos nun 15% e 16%, respectivamente, mentres que C máx diminuíu un 27% e un 31%, respectivamente. T máx o lisinopril aumentou de 6:00 a 8:00, mentres que a digoxina aumentou de 1:00 a 1,5 horas. A partir destes resultados, mentres se usa liraglutido, non é necesario axustar a dose de lisinopril ou digoxina.
Co uso dunha única dose de anticonceptivos orais, o liraglutido reduciu a C máx etinil estradiol ou levonorgestrel nun 12% e un 13%, respectivamente, e t máx aumentou 1,5 horas. Isto non mostrou un efecto clínico na exposición total de etinilestradiol ou levonorgestrel, o que suxire que o uso concomitante de liraglutida non afectará o efecto anticonceptivo de etinilestradiol e levonorgestrel.
Warfarina e outros derivados da cumarina
Non se realizaron estudos de interacción con drogas. Ao comezo do tratamento con Viktoza® para pacientes que reciben warfarina ou outros derivados de cumarina, recoméndase un control frecuente do INR (Ratio Internacional normalizado).
En pacientes con diabetes mellitus tipo 2 estabilizado con administración simultánea de insulina, Detemir (5 U / kg) e liraglutida (1,8 mg) non mostraron signos de interacción farmacocinética e farmacodinámica.
Farmacocinética
Despois da administración subcutánea, a absorción de liraglutidas é lenta, Tmáx (o tempo para alcanzar a concentración máxima) no plasma é de 8-12 horas. Cmáx (concentración máxima) no plasma despois da administración dunha única dose de 0,6 mg é de 9,4 nmol / L. Cando se usa unha dose de 1,8 mg de media Css (concentración de equilibrio) no plasma alcanza aproximadamente 34 nmol / L. A exposición da sustancia aumenta en proporción á dose. O coeficiente de variación intraindividual para AUC (a zona baixo a curva concentración-tempo) tras a administración de liraglutido nunha única dose é do 11%. A biodisponibilidade absoluta é aproximadamente do 55%.
Parecendo Vd (volume de distribución) de liraglutido en tecidos con vía de administración subcutánea é de 11-17 l, o valor medio de Vd despois da administración intravenosa - 0,07 l / kg. Notouse a unión importante do liraglutido con proteínas plasmáticas (> 98%).
O metabolismo do liraglutido ocorre como proteínas grandes, sen participar como vía para a excreción de ningún órgano específico. Durante 24 horas despois da administración dunha única dose, a sustancia inalterada segue sendo o principal compoñente do plasma. Detectáronse dous metabolitos no plasma (≤ 9 e ≤ 5% da dose total).
Non se determina o liraglutido non modificado tras a administración dunha dose de 3-liraglutida en urina ou feces. Só unha pequena fracción dos metabolitos asociados á sustancia son excretados polos riles ou polos intestinos (6 e 5%, respectivamente). Despois da administración subcutánea dunha única dose de liraglutido, a eliminación media do corpo é de aproximadamente 1,2 l / h coa eliminación T1/2 aproximadamente 13 horas.
Formulario de liberación e embalaxe
3 ml de fármaco nun cartucho de vidro de clase hidrolítica 1, enrolado cun disco de caucho bromobutil / poliisopreno por un lado e un pistón de caucho bromobutílico polo outro. O cartucho está selado nunha pluma de xeringa desbotable de plástico para múltiples inxeccións.
2 xeringas desbotables de plástico para múltiples inxeccións xunto con instrucións para uso médico no estado e idiomas rusos colócanse nun paquete de cartón.
Cada pluma de xiringa (3 ml) contén 30 doses de 0,6 mg, 15 doses de 1,2 mg ou 10 doses de 1,8 mg de liraglutido.
Indicacións de uso
Segundo as instrucións, Viktoza úsase para a diabetes tipo 2 en combinación con dieta e exercicio para conseguir o control glicémico.
Posibles formas de usar o medicamento:
- monoterapia
- a terapia combinada con un ou varios axentes hipoglucemicos orais (tiazolidinediones, sulfonilureas, metformina) en pacientes que non lograron un control glicémico adecuado durante a terapia anterior,
- terapia combinada con insulina basal en pacientes que non lograron un control glicémico adecuado usando Victoza en combinación con metformina.
Instrucións de uso Victoza: método e dosificación
Victoza debe administrarse subcutaneamente no abdome, ombreiro ou coxa unha vez ao día, independentemente das comidas. O lugar ea hora da inxección pódense cambiar sen axustar a dose. Non obstante, é conveniente administrar a droga aproximadamente á mesma hora do día, o máis conveniente para o paciente.
Para mellorar a tolerancia gastrointestinal, recoméndase o tratamento cunha dose diaria de 0,6 mg. Despois dun mínimo dunha semana, a dose aumenta ata 1,2 mg. Se é necesario, para conseguir o mellor control glicémico, tendo en conta a eficacia clínica de Victoza, é posible aumentar a dose ata 1,8 mg polo menos unha semana despois. Non se recomenda o uso de doses máis altas.
O medicamento pódese prescribir ademais da terapia en curso con metformina ou terapia combinada con metformina en combinación con tiazolidinione. Non é preciso axustar as doses deste último.
Á vitoria pódese engadir a terapia derivada de sulfonilurea ou a terapia de combinación de metformina en combinación con derivados de sulfonilurea. Neste caso, para minimizar o risco de desenvolver hipoglucemia non desexada, a dose de derivados de sulfonilurea debería reducirse.
Victoza tamén se pode engadir á insulina basal, pero para reducir o risco de hipoglucemia é necesario reducir a dose de insulina.
En caso de perder a dose:
- se non pasaron máis de 12 horas, deberá introducir a dose perdida o antes posible,
- se pasaron máis de 12 horas, a seguinte dose debe administrarse ao día seguinte á hora prevista, é dicir, non é necesario compensar a dose perdida introducindo unha dose adicional ou dobre.
Orientación sobre o uso da droga
Cada pluma de xeringa está deseñada para uso individual.
O medicamento debe administrarse usando agullas de ata 8 mm de longo e ata 32G de grosor (non incluído, polo tanto comprado por separado). As plumas de xeringa combínanse con agullas de inxección desbotables NovoTvist e NovoFayn.
Non se debe administrar Victoza se a solución parece diferente dun líquido claro, case incoloro ou incoloro.
Non pode ingresar a droga se sufriu conxelación.
Non garde a pluma xeringa coa agulla pegada. Despois de cada inxección, debe descartarse. Esta medida evita as fugas, a contaminación e a infección do medicamento e tamén garante a precisión da dosificación.
Condicións de almacenamento
Almacenar de 2 ° C a 8 ° C (no frigorífico). Non conxele.
Para a pluma de xiringa en uso: use dentro dun mes. Almacenar a unha temperatura non superior a 30 ° C nin de 2 ºC a 8 º C (no frigorífico). Non conxele. Non garde coa agulla pegada. Cubra a pluma da xiringa cun tapón para protexelo da luz.
Mantéñase fóra do alcance dos nenos!
Guía de uso e eliminación
Non se pode usar Victoza® se parece diferente a un líquido claro e incoloro ou case incoloro.
Non se pode usar Victoza® se foi conxelado.
Victoza® pódese administrar con agullas de ata 8 mm de longo e ata 32G de grosor. A pluma de xiringa está deseñada para o seu uso en combinación con agullas de inxección desbotables NovoFine® ou NovoTvist®.
As agullas de inxección non están incluídas no paquete.
Debe informar ao paciente de que se debe descartar a agulla usada despois de cada inxección e que non se pode gardar a xeringa coa pluma coa agulla achegada. Tal medida evitará a contaminación, a infección e as fugas do medicamento na pluma xiringante e garantirá unha dosificación precisa.