Os principais efectos secundarios dos glucocorticoides
Moitos anos de experiencia con fármacos glucocorticoides en diversas enfermidades en nenos revelaron non só aspectos positivos, senón tamén negativos deste método de terapia. Verificouse que nalgúns pacientes, as reaccións adversas son temporais e son lixeiramente pronunciadas na natureza e desaparecen sen rastro.
Noutros nenos, despois da abolición do axente glucocorticoide, as complicacións xurdidas, ás veces moi graves, persisten durante moitos anos e ás veces ao longo da vida. A natureza e a gravidade das reaccións adversas e as complicacións dependen da dose e duración diarias do curso do tratamento con fármacos glucocorticosteroides, da idade do neno e das características individuais da reactividade do seu corpo.
Os mecanismos de efectos secundarios provocados por glucocorticosteroides son complexos, porque estes fármacos invaden todos os aspectos da actividade vital do corpo do neno. Non obstante, pódese falar sen dúbida sobre os efectos tóxicos e alérxicos destes fármacos, sobre a súa capacidade de violar aproximadamente o estado de inmunidade, provocar a destrución de tecidos e inhibir os procesos de rexeneración neles, alterando significativamente o metabolismo. As reaccións adversas e as complicacións no tratamento de nenos con glucocorticosteroides poden ser as seguintes.
1.Unha das frecuentes manifestacións de hipercorticismo de drogas creada artificialmente no corpo do neno é a síndrome de Cushingoid: aumento de peso con síntomas dunha peculiar obesidade (redondeo da cara, deposición excesiva de graxa na cara, pescozo, ombreiros, abdome) en combinación con hipertricose, sudoración ou pel seca, a súa pigmentación, aumento do patrón vascular da pel, aparición de acne e estrías.
A maior deposición de graxa (obesidade do tipo masculino) está asociada ao efecto catabólico dos fármacos glucocorticosteroides, o aumento dos procesos de gluconeoxénese e a conversión de hidratos de carbono en graxas. A inhibición dos procesos mobilizadores de graxa estimulados pola hormona do crecemento tamén é importante.
2. Unha reacción adversa frecuente á administración de glucocorticosteroides é a chamada gastrite esteroide, que se manifesta por un deterioro do apetito, azia, náuseas, ás veces vómitos, eructos ácidos, dor na rexión epigástrica.
Tamén é posible unha complicación en forma de erosión e úlceras do estómago e do duodeno (tamén poden ocorrer no intestino delgado e groso). As úlceras gástricas e intestinais ás veces son complicadas por hemorraxia e perforación. Cómpre sinalar que as úlceras estomacais e intestinais nas fases iniciais da súa formación poden ser asintomáticas e un signo da súa existencia é unha reacción positiva ao sangue oculto nas feces.
Máis frecuentemente, as complicacións gastrointestinais aparecen despois de tomar medicamentos con glucocorticosteroides no seu interior, aínda que o seu desenvolvemento non está excluído coa administración parenteral destes fármacos. A aparición do proceso ulcerativo é máis probable cando se prescriben prednisona e prednisona, especialmente en combinación con outros axentes ulcerogénicos (inmunosupresores, ácido acetilsalicílico, tetraciclinas, etc.).
Outros factores contribúen ao desenvolvemento de úlceras:
· Tomar glucocorticosteroides antes das comidas,
A administración a longo prazo de altas doses destes fármacos sen interrupción no tratamento,
· Incumprimento da dieta durante a terapia con glucocorticosteroides (inxestión de alimentos picantes e irritantes, especias, alimentos fríos ou quentes, etc.).
Os glucocorticosteroides provocan a formación de úlceras do estómago e dos intestinos debido ás seguintes razóns:
· Aumentan a acidez e secreción do zume gástrico e ao mesmo tempo perturban a formación de moco, que protexe a membrana mucosa do estómago e dos intestinos de efectos nocivos (inhibe a síntese de polisacáridos que compoñen as membranas mucosas do estómago e os intestinos),
· Os glucocorticosteroides debilitan os procesos de curación das úlceras micro e macro do estómago e do intestino, é dicir, baixo a súa influencia inhibe a proliferación de células do tecido glandular e conectivo das paredes destes órganos. O curso asintomático (indolor) do proceso ulcerativo explícase polo feito de que a ulceración se produce no contexto do efecto antiinflamatorio dos medicamentos glucocorticosteroides.
3. No proceso de tomar fármacos glucocorticosteroides, a exacerbación da infección focal (amigdalite, sinusite, caries dental, colecistite e outros), pódese observar unha xeneralización do proceso infeccioso. Descríbense casos de pneumonía e supuración pulmonar de orixe autoinfectosa, exacerbación de enfermidades crónicas (hepatite, colecistite, pancreatite, tuberculose e outras).
Obsérvase que o nomeamento de glucocorticosteroides provoca un curso máis grave de infeccións virais en nenos, empeora notablemente a eficacia da vacinación. Os efectos secundarios enumerados anteriormente explícanse pola capacidade dos glucocorticosteroides para suprimir as reaccións sistémicas e de defensa local.
4. No tratamento con glucocorticosteroides, son posibles cambios na esfera mental e emocional: labilidade emocional, logorrea, axitación psicomotora, trastorno do sono. Estes cambios nos nenos son reversibles.
5. Unha reacción adversa frecuente coa terapia con glucocorticosteroides é un aumento da presión arterial. Despois do alta do hospital, a hipertensión arterial pasa a pacientes, aínda que nalgúns nenos o aumento da presión arterial en 15 - 20 mm RT. Art. persiste de 1 a 3 anos a falta de reclamacións (A. V. Dolgopolova, N. N. Kuzmina, 1963).
O mecanismo de hipertensión arterial no hipercorticismo farmacológico segue sen estar claro. Máis frecuentemente, unha reacción así se rexistra na prepuberta e na puberdade.
6. Algúns glucocorticosteroides (cortisona, hidrocortisona, prednisona, prednisona) teñen a capacidade de reter sodio e auga no corpo do paciente, o que contribúe á aparición de edema e ao aumento do peso corporal. Tales fármacos glucocorticosteroides como a dexametasona, triamcinolona, metilprednisolona non retrasan o sodio e a auga.
7.Con terapia glucocorticosteroide masiva e prolongada en mozas adolescentes, a miúdo obsérvanse trastornos endocrinos: o atraso na aparición da primeira menstruación, a súa irregularidade, cando xa están establecidas. Hai que ter en conta isto e sen indicios estritos non prescribir estes fármacos ás nenas no período de puberdade, cancelalos cando aparezan os primeiros signos destes fenómenos negativos.
8. A literatura proporciona evidencias de que baixo a influencia da administración a longo prazo de fármacos glucocorticosteroides, pode producirse un retraso no crecemento do corpo do neno. Este fenómeno explícase polo efecto inhibidor dos glucocorticosteroides sobre a produción de hormona de crecemento pola glándula hipofisaria e a formación de somatomedina no fígado, un aumento dos procesos catabólicos nos tecidos, incluído o óso.
9. Na infancia, a diabetes mellitus pode desenvolverse por influencia de glucocorticosteroides a partir de prediabetes.
O mecanismo de formación da diabetes esteroide está asociado a características da acción dos fármacos glucocorticosteroides sobre o metabolismo dos carbohidratos: inhiben a función do aparello insular do páncreas, estimulan a produción de proteínas plasmáticas que se unen á insulina, activan o proceso de formación de glicosa a partir de aminoácidos e ao mesmo tempo debilitan a utilización de hidratos de carbono por tecidos.
En última instancia, desenvólvese hiperglucemia e glucosuria e en nenos con vulnerabilidade hereditaria do aparello insular - diabetes. Na maioría dos pacientes, despois da abolición dos glucocorticosteroides, o metabolismo dos carbohidratos normalízase. A dexametasona é capaz de causar perturbacións especialmente pronunciadas no metabolismo dos carbohidratos, menos que triamcinolona, metilprednisolona, prednisolona, prednisona. A diabetogenicidade mínima é característica de cortisona e hidrocortisona.
10. Unha reacción adversa frecuente do corpo do neno á administración de glucocorticosteroides é a aumento da excreción de potasio na urina e o desenvolvemento da síndrome hipokalémica.
Signos deste último: sensación de debilidade, malestar, perda de ton muscular e forza (ás veces paresis de extremidades), debilitamento da función do miocardio, arritmia cardíaca, náuseas, vómitos, estreñimiento.
A posibilidade de desenvolver unha síndrome hipokalémica aumenta coa administración de glucocorticosteroides en combinación con glicosidas e diuréticos cardíacos, ao mesmo tempo que ignora a dieta de potasio e unha compensación insuficiente por perdidas farmacásicas de potasio debido á administración adicional de medicamentos que contienen potasio.
11. Acumuláronse moitas observacións clínicas que indican os efectos negativos dos fármacos glucocorticosteroides no sistema esquelético do corpo en crecemento dun neno. A osteopatía esteroide exprésase na aparición de osteoporose de ósos, costelas e corpos vertebrais predominantemente longos. Moitas veces, o desenvolvemento da cartilaxe epifisal é perturbado, ás veces aparecen signos de necrose aséptica dos ósos.
Unha complicación moi grave é a brevispondilia: a formación de vértebras de peixe (debido á destrución dos corpos vertebrais e dos discos intervertebrais), seguida dunha posible violación das raíces nerviosas, fractura da columna vertebral, compresión da medula espiñal.
A osteopatía esteroide é o resultado de violacións graves na síntese de estruturas proteicas do tecido óseo (diminución da cantidade de coláxeno, mucopolisacáridos, hexosamina), aumento dos procesos de reabsorción de calcio do tecido óseo e excreción excesiva do mesmo e fósforo na orina. Os procesos reparadores no tecido óseo de pacientes con osteopatía esteroide caracterízanse por letarxia e duración.
12. Nalgúns pacientes, a miopatía desenvólvese baixo a influencia de fármacos glucocorticosteroides.
Síntomas dela: debilidade muscular (principalmente nas extremidades inferiores próximas e músculos do tronco), hipotensión, diminución dos reflexos do tendón. Ao examinarse, pódense observar signos de hipertrofia muscular, especialmente das extremidades inferiores (o contido de glicóxeno nos músculos aumenta). Está demostrada a violación da estrutura das sinapses neuromusculares. A triamcinolona que contén flúor adoita causar miopatía. A miopatía esteroide despois da extracción do medicamento desaparece gradualmente, e a función e a estrutura dos músculos son restaurados pola cavidade.
13. O uso de glucocorticosteroides (especialmente nos casos de administración a longo prazo de doses masivas de fármacos) está cheo do perigo de complicacións do órgano da visión en forma de enturbación da lente e do glaucoma. Os cambios na lente poden converterse en irreversibles debido ao encapsulado do humor acuoso, a compactación da parte posterior da mesma. O glaucoma na infancia é raro.
14. Aínda que os fármacos glucocorticosteroides son un poderoso factor terapéutico nas alerxias, nalgúns casos producen reaccións alérxicas ata un choque anafiláctico. Tales reaccións ocorren a miúdo con repetidos cursos de terapia con glucocorticosteroides e maniféstanse en forma de urticaria, edema de Quincke, eritema multiforme, picazón na pel e outros signos.
15. O uso a longo prazo de fármacos glucocorticosteroides e o estado de hipercorticismo farmacoxénico resultante está cheo do perigo de inhibición da función da capa cortical das glándulas suprarrenais e da reestruturación compensatoria do sistema hipotalámico-xenefisial-suprarrenal.
Neste contexto, cunha retirada repentina do medicamento, a síndrome de retirada pode desenvolverse en forma de ataque de debilidade severa, debilidade, cefaléia, diminución do rendemento mental e físico e un moderado aumento da temperatura corporal.
O síndrome de retirada é especialmente perigoso nos casos en que se detén a administración de grandes doses de glucocorticosteroides sen unha preparación previa do corpo do paciente, é dicir, sen unha diminución gradual da dose diaria do medicamento, a introdución de axentes quimioterapéuticos que estimulen a función da córtex suprarrenal.
Así, o grupo de fármacos glucocorticosteroides caracterízase non só polos seus poderosos efectos terapéuticos sobre o corpo do paciente, senón tamén por moitos fenómenos negativos, cuxa gravidade e esencia depende tanto do medicamento mesmo, do método de uso, da idade e do sexo do neno e doutros factores, por desgraza. aínda non estudado.
A terapia farmacolóxica para HA pode ser intensiva (a curto prazo), limitada (durante varios días ou meses) e a longo prazo (tratamento durante varios meses, anos ou incluso durante toda a vida).
Non atopaches o que buscabas? Usa a busca:
Efectos secundarios dos glucocorticoides sistémicos
Índice
Efectos secundarios
■ Inhibición da función e atrofia da córtex suprarrenal, dependencia de esteroides, "síndrome de retirada" (exacerbación da enfermidade subxacente, insuficiencia suprarrenal). A terapia a longo prazo con glucocorticoides sistémicos, especialmente realizada sen ter en conta os ritmos fisiolóxicos circadianos da súa secreción, leva á inhibición e atrofia da córtex suprarrenal. Para a inhibición completa da cortiza suprarrenal nun paciente adulto, a dose diaria de glucocorticoide exóxeno debe ser de 10 a 20 mg en termos de prednisona. A diminución da función da cortiza suprarrenal comeza no 4º e 7º día de uso diario de doses medias de glucocorticoides cando se prescriben pola mañá e a partir do 2º día cando se prescriben pola noite. Este efecto secundario é máis característico dos glucocorticoides orais de longa duración e dos preparativos de depósito. Para restaurar a función secretora normal da córtex suprarrenal, necesítanse polo menos 6-9 meses, ea súa resposta adecuada ás tensións é de 1-2 anos.
■ Adelgazamento da pel, estrías, calvicie.
■ Osteoporose, fracturas e necrosis aséptica dos ósos, retraso do crecemento. A osteoporose desenvólvese nun 30-50% dos pacientes e é a complicación máis grave da terapia con glucocorticoides. É debido ao seu efecto negativo sobre a formación de tecido óseo e a activación da súa resorción. A miúdo desenvólvese en mulleres na posmenopausa. Por regra xeral, a osteoporose afecta ás partes centrais do esqueleto (columna vertebral, ósos pélvicos, costelas) e esténdese gradualmente aos ósos periféricos (mans, pés, etc.). As súas manifestacións clínicas son dor na articulación da columna vertebral e cadeira, diminución do crecemento e fracturas da columna vertebral (torácica e lumbar inferior). departamentos), costelas, pescozo femoral, derivadas de feridas leves ou espontaneamente. Para tratar esta complicación, úsanse preparados de calcio, vitamina D3, calcitonina e bisfosfonatos. A duración desta terapia debe ser de varios anos.
• Miopatía, desperdicio muscular, distrofia de miocardio. As miopatías esteroides maniféstanse por debilidade e atrofia dos músculos esqueléticos, incluídos os músculos respiratorios (músculos intercostais, diafragma), o que contribúe ao desenvolvemento de insuficiencia respiratoria. A maioría das veces, esta complicación provoca triamcinolona. O mecanismo de desenvolvemento de miopatías está asociado ao efecto negativo dos glucocorticoides sobre o metabolismo proteico e mineral. Para o seu tratamento úsanse esteroides anabólicos e preparados de potasio.
■ Hipokalemia, retención de sodio e auga, edema son manifestacións dos efectos mineralocorticoides dos glucocorticoides.
■ Os pacientes que toman glucocorticoides durante moito tempo pódense observar un aumento da presión arterial. Débese a unha maior sensibilidade da parede vascular ás catecolaminas, á retención de sodio e auga.
■ O dano á parede vascular co desenvolvemento de "vasculite esteroide" é frecuentemente causado por medicamentos fluorados (dexametasona e triamcinolona). Caracterízase por unha maior permeabilidade vascular. Maniféstase por hemorragias na pel do antebrazo, membranas mucosas da cavidade oral, conxuntiva dos ollos, epitelio do tracto gastrointestinal. Para o tratamento úsanse vitaminas C e P, así como axentes vasculares anti-bradicinina.
■ Un aumento da coagulabilidade do sangue pode levar á formación de coágulos de sangue nas venas profundas e tromboembolismo.
■ Reducir a rexeneración dos tecidos debido aos efectos anti-anabólicos e catabólicos no metabolismo das proteínas, reducindo a síntese de proteínas de aminoácidos, aumentando a ruptura de proteínas
■ Úlceras esteroides do estómago e intestinos, hemorraxias gastrointestinais. As úlceras esteroides son a miúdo asintomáticas ou asintomáticas, manifestando hemorraxia e perforación. Polo tanto, os pacientes que reciben glucocorticoides orais durante moito tempo deben examinarse periódicamente (fibroesophagogastroduodenoscopy, exame de sangue oculto fecal). O mecanismo de acción ulcerogénica dos glucocorticoides está asociado ao seu efecto catabólico e supresión da síntese de prostaglandina e consiste en aumentar a secreción de ácido clorhídrico, reducindo a formación de moco e inhibindo a rexeneración do epitelio. Esta complicación é máis frecuentemente causada por prednisona.
■ A pancreatite, o fígado graxo, a obesidade, a hiperlipidemia, a hipercolesterolemia, a embolia é a consecuencia do efecto anabólico dos glucocorticoides sobre o metabolismo da graxa: maior síntese de triglicéridos, ácidos graxos e colesterol, redistribución da graxa.
■ Aumento da excitabilidade do SNC, insomnio, euforia, depresión, psicose, síntomas do meningismo, convulsións en pacientes con epilepsia.
■ Catarata posterior subcapsular, glaucoma, exoftalmos.
■ Diabetes esteroides, hiperglucemia. Os glucocorticoides aumentan a absorción de carbohidratos do tracto gastrointestinal, aumentan a gluconeoxénese, reducen a actividade da insulina e a hexokinase e reducen a sensibilidade dos tecidos á insulina e a súa utilización da glicosa. Para o tratamento da diabetes esteroide, úsase unha dieta restrinxida de hidratos de carbono, drogas hipoglicémicas orais e insulina.
■ A violación do ciclo menstrual, as funcións sexuais, o retraso desenvolvemento sexual, o hirsutismo, o desenvolvemento fetal deteriorado están asociadas a unha diminución da produción de hormonas sexuais.
■ Supresión da inmunidade, agravamento de procesos infecciosos e infecciosos crónicos, incluíndo tuberculose, infección secundaria, xeneralización da infección local. Por regra xeral, as complicacións infecciosas son asintomáticas debido ao efecto antiinflamatorio dos glucocorticoides. É característico o desenvolvemento da candidiasis da cavidade oral e da faringe.
■ Síndrome de Cushing (mobilización de graxa da graxa subcutánea das extremidades, deposición excesiva de graxa na cara, pescozo, cintura e abdomen, hipertricose, estrías, acne, alteración da tolerancia á glicosa, etc.).
■ Cambios hematolóxicos.
■ Manifestada por leucocitosis neutrófila sen desprazamento da fórmula leucocitaria cara á esquerda. Crese que se deben ao efecto estimulante dos esteroides sobre a granulopoiese.
Prevención de complicacións
■ Uso dun réxime de tratamento intermitente (alternativo).
■ Uso de glucocorticoides sistémicos na dose mínima requirida. Para iso, no asma bronquial, a súa administración debe combinarse co uso de glucocorticoides inhalados en combinación con agonistas β2-adrenérxicos de acción longa, teofilina ou medicamentos antileukotrienos.
■ Administración de glucocorticoides de acordo co ritmo fisiolóxico diario de secreción de cortisol.
■ O uso dunha dieta rica en proteínas e calcio, coa restrición de hidratos de carbono facilmente digeribles, sal (ata 5 g por día) e líquido (ata 1,5 litros por día).
■ Tomar comprimidos glucocorticoides despois das comidas para reducir o seu efecto ulcerogénico.
■ Eliminación de tabaquismo e abuso de alcol.
■ Exercicio non traumático moderado.
O concepto de glucocorticoides, o seu uso como medicamentos, clasificación por estrutura e acción. Formas de regulación da síntese e secreción de hormonas da córtex suprarrenal O mecanismo de acción dos glucocorticoides, os principais efectos secundarios do seu uso.
| Título | Medicina |
| Ver | abstracto |
| Lingua | Ruso |
| Data engadida | 22.05.2015 |
| Tamaño do ficheiro | 485,1 K |

Someter o teu bo traballo á base de coñecemento é fácil. Use o seguinte formulario
Os estudantes, estudantes de posgrao, científicos novos que usen a base de coñecemento nos seus estudos e traballo estarán moi agradecidos.
Publicado o http://www.allbest.ru/
Ministerio de Saúde de Ucraína
Universidade Estatal de Medicina Zaporizhzhya
Departamento de Farmacoloxía e Prescrición Médica
Por tema: "Farmacoloxía"
Sobre o tema: "Efectos secundarios dos glucocorticoides"
Feito: estudante de 3º curso
Saiko Roman Eduardovich
1. Clasificación dos glucocorticoides
2. O mecanismo de acción dos glucocorticoides
3. O uso de glucocorticoides
4. Os principais efectos secundarios dos glucocorticoides
5. Prevención de efectos secundarios dos glucocorticoides
Lista de referencias
1.Clasificación dos glucocorticoidesen
Os glucocorticoides son hormonas esteroides sintetizadas pola córtex suprarrenal. Os glucocorticoides naturais e os seus análogos sintéticos úsanse na medicina para a insuficiencia suprarrenal. Ademais, algunhas enfermidades utilizan estas propiedades antiinflamatorias, inmunosupresoras, antialerxias, anti-choque e outras propiedades.
O comezo do uso de glucocorticoides como medicamentos (PM) data dos anos 40. Século XX A finais dos anos 30. do século pasado, demostrouse que os compostos hormonais de natureza esteroide están formados na córtex suprarrenal. En 1937, a mineraloxorticoide desoxicorticosterona foi illada da cortiza suprarrenal, nos anos 40. - Garcocorticoides cortisona e hidrocortisona. Unha ampla gama de efectos farmacolóxicos da hidrocortisona e da cortisona predeterminaron a posibilidade do seu uso como fármacos. Logo, levouse a cabo a súa síntese.
O glucocorticoide principal e máis activo formado no corpo humano é a hidrocortisona (cortisol), outros menos activos están representados por cortisona, corticosterona, 11-desoxicortisol, 11-deshidrocorticosterona.
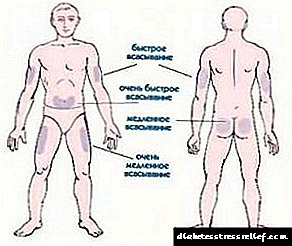
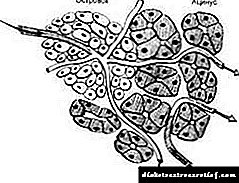
A produción de hormonas polas glándulas suprarrenais está baixo o control do sistema nervioso central e está intimamente relacionada coa función da glándula pituitaria (ver Fig. 2). A hormona hipofisaria adrenocorticotrópica (ACTH, corticotropina) é un estimulante fisiolóxico da córtex suprarrenal. A corticotropina mellora a formación e secreción de glucocorticoides. Este último, á súa vez, afecta á glándula pituitaria, inhibindo a produción de corticotropina e reducindo así unha maior estimulación das glándulas suprarrenais (polo principio de retroalimentación negativa). A administración prolongada de glucocorticoides (cortisona e os seus análogos) no corpo pode levar á inhibición e atrofia da córtex suprarrenal, así como á inhibición da formación non só de ACTH, senón tamén de hormonas hipofisarias gonadotrópicas e tiroides estimulantes.
Fig.Clasificación de glucocorticoides e métodos para o seu uso
Fig.Formas de regulación da síntese e secreción de hormonas da córtex suprarrenal
Dende os anos 50 do século pasado, os glucocorticoides ocuparon un lugar importante en diversos campos da medicina e, sobre todo, na práctica terapéutica. A síntese de formas de glucocorticoides para administración intravenosa e intramuscular ampliou significativamente as posibilidades da terapia con glucocorticoides. Nos últimos 15-20 anos, as nosas ideas sobre os mecanismos de acción dos glucocorticoides expandíronse significativamente, e tamén houbo graves cambios na táctica de uso de glucocorticoides, incluídas as dosagens, as vías de administración, a duración do uso e as combinacións con outras drogas.
O uso de glucocorticoides na práctica clínica data de 1949, cando se informou por primeira vez do excelente efecto a corto prazo de pacientes con artrite reumatoide. En 1950, o mesmo grupo de investigación informou sobre os bos resultados do tratamento da artrite reumatoide, o reumatismo e outras enfermidades reumáticas con cortisona e hormona adrenocorticotrópica (ACTH). Pronto, unha serie de informes mostraron o brillante efecto da terapia con glucocorticoides para o lupus eritematoso sistémico (LES), dermatomiosite e vasculite sistémica.
Hoxe, os glucocorticoides, a pesar do alto risco de efectos secundarios (incluídos os graves), seguen a ser a pedra fundamental no tratamento patoxenético de moitas enfermidades reumáticas. Ademais, son moi empregados en moitas enfermidades hematolóxicas, glomerulonefrite primaria e secundaria, así como nunha serie de enfermidades gastrointestinais e respiratorias, condicións alérxicas, choques de varias orixes e moito máis. A síntese de glucocorticoides para uso intravenoso, intramuscular e intraarticular expandiu o alcance e a táctica do seu uso.
Os corticosteroides suprarrenais divídense en dúas categorías principais: glucocorticoides e mineralocorticoides. As primeiras teñen un efecto sobre case todos os órganos e sistemas do corpo, ao influír nos procesos metabólicos intermedios, as funcións inmunes e as reaccións inflamatorias. A función principal dos mineralocorticoides é regular o metabolismo da auga-sal.
O uso xeneralizado de glucocorticoides está motivado polos seus poderosos efectos antiinflamatorios, inmunosupresores e antialerxicos.
No I Simposio Europeo sobre terapia con glucocorticoides, recoméndase empregar os termos glucocorticoides ou glucocorticosteroides. Outros termos: "esteroides", "corticoides", "corticoides" son demasiado amplos ou insuficientemente precisos e, polo tanto, non se recomenda usalos.
Na práctica clínica na actualidade úsanse exclusivamente glucocorticoides sintéticos, que teñen unha importante actividade antiinflamatoria, inmunosupresora e antialerxica con efectos mineralocorticoides débiles ou incluso nulos, e polo tanto están entre os fármacos máis usados en diversos campos da medicina.
Clasificación dos glucocorticoides por estrutura química
Glucocorticoides naturais (endóxenos):
* cortisol * hidrocortisona * acetato de hidrocortisona
Glucocorticoides que conteñen aceite sintético:
* prednisolona * prednisona * metilprednisolona
Glucocorticoides que conteñen flúor sintéticos:
* dexametasona * triamcinolona * betametasona
Clasificación dos glucocorticoides por duración da acción
Drogas de corta acción (8-12 horas):
Medicamentos de duración media da acción (12-36 horas):
* prednisolona * metilprednisolona * triamcinolona
Drogas de longa acción (36-72 horas):
* parameterazone * betametasona * dexametasona
Os glucocorticoides do depósito caracterízanse por unha exposición máis longa (eliminación nunhas semanas).
2.Pelanismo glucocorticoide
O eixe hipotálamo-hipofisario-suprarrenal forma un sistema complexo que regula a liberación de glucocorticoides en condicións fisiolóxicas e en diversas condicións patolóxicas. A produción de cortisol pola cortiza suprarrenal está regulada por ACTH, segregada pola glándula pituitaria anterior. A liberación de ACTH, á súa vez, está regulada por unha hormona liberadora de corticotropina, a secreción da cal está controlada por sistemas neurolóxicos, endocrinos e citocinas ao nivel dos núcleos periventriculares do hipotálamo. A hormona liberada por corticotropina é transportada en pequenas porcións á circulación portal local da glándula pituitaria, e logo ao seu lóbulo anterior, onde a hormona liberada por corticotropina estimula a secreción de ACTH. lado do medicamento glucocorticoide
A secreción basal diaria de cortisol nos humanos é de aproximadamente 20 mg. Ademais, a súa secreción caracterízase por flutuacións durante o día con maiores niveis na madrugada e valores baixos pola noite. A maioría do cortisol segregado (arredor do 90%) circula con globulinas sanguíneas que unen corticoides. O cortisol libre é unha forma biológicamente activa da hormona.
A hiperreactividade do eixe hipotalámico-hipofisario-suprarrenal en ausencia de inflamación (por exemplo, coa síndrome de Cushing) provoca inmunosupresión e aumenta a sensibilidade á infección. A activación do eixe hipotalámico-hipofisario-suprarrenal, causando un aumento dos niveis de cortisol e que leva á inmunosupresión, pode ser causada por varios factores de estrés, incluíndo dor, trauma emocional, frío, gran esforzo físico, infeccións, intervencións cirúrxicas, limitando a restrición de calorías dos alimentos e moito máis. Os glucocorticoides endóxenos, xunto cun papel homeostático, modifican tamén as respostas antiinflamatorias. Preséntase evidencia de que a resposta deteriorada de glucocorticoides endóxenos xoga un papel importante na patoxénese de varias enfermidades sistémicas do tecido conectivo ou na persistencia do proceso inflamatorio. En enfermidades reumáticas como a artrite reumatoide, a LES, a dermatomiosite e outros, prodúcense cambios significativos no eixe hipotalámico-hipofisario-suprarrenal, caracterizados por unha secreción inadecuada de ACTH en relación ás citocinas circulantes, unha secreción basal inadecuada e estimulada de cortisol en resposta á inflamación, así como unha redución significativa de cortisol como resposta a inflamación. andróxenos.
A utilización de glucocorticoides sintéticos leva á inhibición da síntese e á liberación da hormona liberadora de corticotropina e da ACTH e, consecuentemente, a unha diminución da produción de cortisol. A terapia con glucocorticoides a longo prazo produce atrofia suprarrenal e supresión do eixe hipotalámico-hipofisario-suprarrenal, provocando unha diminución da capacidade de producir glucocorticoides endóxenos adicionais en resposta a factores de ACTH e estrés.
Actualmente, é habitual distinguir entre dous mecanismos de acción dos glucocorticoides: xenómico e non xenómico.
O mecanismo xenómico mediante a unión de receptores citoplasmáticos específicos obsérvase en calquera dosificación e aparece non antes de 30 minutos despois da formación do complexo hormona-receptor.
O mecanismo fundamental da acción xenómica dos glucocorticoides é a regulación da transcrición de xenes que controlan a síntese de proteínas e ADN. O efecto dos glucocorticoides sobre os receptores de glucocorticoides (que son membros da familia de receptores de esteroides da membrana) leva ao desenvolvemento dun complexo de eventos que inclúen ARN mensaxeiro específico, ARN nuclear e outras sustancias promotoras. O resultado desta cascada é a estimulación ou inhibición da transcrición xénica. Os glucocorticoides afectan a unha gran cantidade de xenes, incluíndo xenes que controlan a formación de citocinas como IL-la, IL-4, IL-6, IL-9 e interferón gamma. Neste caso, os glucocorticoides poden mellorar a transcrición dos xenes e suprimila.
Os glucocorticoides tamén controlan a síntese de proteínas celulares. Penetrando facilmente e rapidamente a través das membranas celulares, forman complexos con receptores de esteroides no citoplasma que migran ao núcleo celular, realizando a transcrición no aparato xenético
ARN mensaxeiro específico para a síntese de péptidos e proteínas reguladoras, asociado principalmente a un sistema de enzimas que, á súa vez, controlan a función celular.Estas encimas poden realizar funcións de estimulación e inhibición. Por exemplo, poden estimular a produción de proteínas inhibidoras nalgunhas células, o que detén completamente a transcrición de xenes en células linfoides, modulando así as respostas inmunes e inflamatorias.
Os glucocorticoides afectan ás funcións inmunes celulares e humorais. O desenvolvemento da linfocitopenia baixo a súa influencia débese á inhibición da produción e liberación de células linfoides da medula ósea, inhibición da súa migración e redistribución de linfocitos a outras seccións linfoides. Os glucocorticoides afectan á interacción cooperativa das células T e B na resposta inmune. Actuan de xeito diferente sobre diferentes subpoblacións de linfocitos T, provocando unha diminución do nivel de receptores portadores de células T para o fragmento de FM IgM e sen cambiar o nivel de receptores portadores dos linfocitos T para o fragmento FG de IgG. Baixo a influencia dos glucocorticoides, as habilidades proliferativas das células T son suprimidas tanto in vivo como in vitro. O efecto dos glucocorticoides nas respostas das células B maniféstase en menor medida que nas células T. Así, en pacientes que reciben doses medias de glucocorticoides, obsérvanse as respostas normais aos anticorpos á inmunización. Ao mesmo tempo, a administración a curto prazo de grandes doses de glucocorticoides provoca unha diminución dos niveis séricos de IgG e IgA e non afecta os niveis de IgM. O efecto dos glucocorticoides sobre a función das células B pódese mediar debido ao seu efecto nos macrófagos.
A diferenza dos efectos xenómicos, os glucocorticoides non xenómicos son o resultado dunha interacción fisicoquímica directa con membranas biolóxicas e / ou receptores de membrana selectivos de esteroides. Os efectos non xenómicos dos glucocorticoides desenvólvense baixo a influencia de doses máis altas e aparecen despois duns segundos ou minutos.
O efecto antiinflamatorio non xenómico dos glucocorticoides está asociado á estabilización das membranas lisosómicas, unha diminución da permeabilidade das membranas celulares, unha diminución da permeabilidade capilar e o fluxo sanguíneo local nas áreas de inflamación, unha diminución do inchazo das células endoteliais, unha diminución da capacidade dos complexos inmunes para penetrar na membrana basal, inhibir a crecemento da síntese e inhibir a crecemento vasos no foco da inflamación e diminución da súa permeabilidade (parcialmente debido
inhibición da síntese de prostaglandina), unha diminución do número de monocitos e células mononucleares no foco da inflamación, así como un efecto sobre os leucocitos polimorfonucleares. Obviamente, o papel principal no efecto antiinflamatorio dos glucocorticoides pertence á inhibición da migración e á acumulación de leucocitos nos focos da inflamación. Baixo a influencia dos glucocorticoides, a actividade bactericida, a unión do receptor Fc e outras funcións de monócitos e macrófagos son interrompidas e os niveis de eosinófilos, monocitos e linfocitos na circulación diminúen. Ademais, as respostas celulares ás quininas, histamina, prostaglandinas e factores quimiotácticos cambian e a liberación de prostaglandinas das células estimuladas diminúe. Un mecanismo non xenómico ben estudado implica a activación da sintase endotelial de óxido nítrico.
A dose de glucocorticoides determina a súa eficacia, así como a frecuencia e gravidade dos efectos secundarios. Os efectos xenómicos dos glucocorticoides desenvólvense en dosis mínimas e aumentan a medida que se alcanza aproximadamente 100 mg de prednisolona equivalente ao día e permanecen estables no futuro. Se ao usar glucocorticoides nunha dose de ata 30 mg de equivalente prednisolona, o resultado terapéutico está determinado case por completo mediante mecanismos xenómicos, entón nunha dose de máis de 30 mg de equivalente prednisolona, os efectos non xenómicos fanse significativos, o papel dos cales aumenta rapidamente coa dose cada vez maior.
Os glucocorticoides son ben reabsorbidos para todas as variantes do seu uso, é dicir, para a vía oral, intramuscular, intravenosa ou intraarticular. Despois da administración oral, absorbe aproximadamente o 50-90% dos glucocorticoides. A unión dos glucocorticoides ás proteínas do sangue é aproximadamente do 40-90%. O metabolismo dos glucocorticoides realízase principalmente no fígado e a excreción - principalmente polos riles en forma de metabolitos. A concentración máxima de glucocorticoides no sangue despois da administración oral ocorre despois das 4-6 horas. Coa administración intravenosa de glucocorticoides, o pico da súa concentración conséguese moito máis rápido. Así, coa introdución de 1,0 g de Solomedrol® (succinato sódico de metilprednisolona), obsérvase un pic na súa concentración plasmática despois de 15 minutos. Con administración intramuscular de glucocorticoides, o pico da súa concentración no plasma prodúcese significativamente
despois. Por exemplo, coa inxección intramuscular de Depo-medrol® (acetato de metilprednisolona), a súa concentración máxima no sangue alcánzase ao cabo de aproximadamente 7 horas.
3. O uso de glucocorticoides
Os mecanismos de acción polifacéticos descritos dos glucocorticoides e varios puntos da súa aplicación serviron de base para o seu uso xeneralizado en moitas enfermidades de órganos internos, así como varias condicións patolóxicas. Xunto ás enfermidades reumáticas e á vasculite sistémica, onde os glucocorticoides son a miúdo os fármacos básicos, a terapia con glucocorticoides tamén se usa en endocrinoloxía, gastroenteroloxía, reanimación, cardioloxía, pulmonoloxía, nefroloxía, traumatoloxía e moito máis.
A continuación, presentamos enfermidades e condicións patolóxicas onde se utilizan glucocorticoides:
1.Artrite reumatoide - a falta de manifestacións extraarticulares severas da enfermidade (vasculite sistémica, serositis, miocardite, alveolite fibrosante, bronquiolite obliterans), úsanse baixas doses de glucocorticoides no fondo da terapia que modifica a enfermidade. Co desenvolvemento das anteriores manifestacións extraarticulares de artrite reumatoide, úsanse medias e, se é preciso, altas doses de glucocorticoides.
2. Espondilite anquilosante: na fase activa utilízanse dosagens medicos ou altos de glucocorticoides.
3. Lupus eritematoso sistémico - na fase activa da enfermidade, así como cando os órganos e sistemas vitais están implicados no proceso patolóxico (pericardite grave e / ou pleurisía con acumulación masiva de exudado e / ou miocardite e / ou danos no sistema nervioso central e / ou pneumonite pulmonar , e / ou hemorragias pulmonares, e / ou anemia hemolítica e / ou purpura trombocitopénica e / ou clases morfolóxicas de glomerulonefritis III, IV, V) mostra o uso de doses medias ou altas de glucocorticoides, e se é necesario - moi elevado FIR.
4. Febre reumática aguda ou exacerbación do reumatismo: doses medias ou altas de glucocorticoides (especialmente co desenvolvemento de carditis reumática).
5. Polimialxia reumática: os glucocorticoides son os fármacos que escollen. Na etapa aguda utilízanse dosagens medicos ou altos de glucocorticoides.
6. Polimiosite e dermatomiosite - Os glucocorticoides son os fármacos que escollen. Na fase aguda, prescríbense altas doses de glucocorticoides.
7. Esclerodermia sistémica: os glucocorticoides son prescritos en doses baixas e medias co desenvolvemento de miositis.
8. A enfermidade de aínda - na fase aguda, así como cando os órganos e sistemas vitais (miocardite, pericardite, epilepsia) están implicados no proceso patolóxico - doses medias ou altas de glucocorticoides.
1.Arterite de células xigantes: na etapa aguda, os glucocorticoides son o tratamento que elixe e son prescritos en altas dosificación.
2. Enfermidade de Takayasu: no estadio agudo empréganse doses medias ou altas de glucocorticoides.
3. Poliarteritis nodular e polianxiite microscópica: na etapa aguda utilízanse altas doses de glucocorticoides.
4. A enfermidade de Wegener - en fase aguda - altas doses de glucocorticoides.
5. Síndrome de Charge-Strauss - terapia en fase aguda á elección - altas doses de glucocorticoides.
6. Síndrome de Behcet: no estadio agudo prescríbense doses medias ou altas de glucocorticoides.
7. Vasculite leucocitoclástica cutánea: en casos graves utilízanse altas doses de glucocorticoides.
8. Vasculite hemorrágica (Shenlein-Genoch purpura) - Os glucocorticoides son prescritos en doses medianas ou altas co desenvolvemento de glomerulonefrite con síndrome nefrótico e / ou coa formación do 50-60% de glomérulos e máis de media lúa. Segundo varios reumatólogos, pódense usar doses medias de glucocorticoides para a síndrome abdominal.
1.A glomerulonefrite con cambios mínimos (síndrome nefrótico idiopático): nas etapas iniciais da enfermidade ou coas súas exacerbacións, os tratamentos de glucocorticoides prescritos en doses medianas ou altas son a elección.
2. Glomerulosclerose focal-segmental-hialinose: nas fases iniciais da enfermidade ou con exacerbacións, úsanse doses medias ou altas de glucocorticoides.
3. As glomerulonefritis mesangioproliferativas medias ou altas doses de glucocorticoides úsanse no desenvolvemento da síndrome nefrótica e / ou media lúa nos glomérulos 50-60%.
4. Glomerulonefrite mesangiocapilar: altas doses de glucocorticoides úsanse para o desenvolvemento da síndrome nefrótica e / ou media lúa nos glomérulos 50-60%.
5. Glomerulonefrite membranosa: en presenza de síndrome nefrótico, úsanse doses medias ou altas de glucocorticoides.
6. Glomerulonefrite de progreso rápido (subagudo, lunado): úsanse altas doses de glucocorticoides.
A glomerulonefritis secundaria (é dicir, a glomerulonefrite que se desenvolveu con SLE, artrite reumatoide, polimiosite, dermatomiosite, vasculite) usan doses medias ou altas de glucocorticoides.
1.A deficiencia de ACTH en varias enfermidades da glándula pituitaria: hidrocortisona ou doses alternativamente baixas de glucocorticoides úsanse como terapia de reposición.
2. Tirotoxicosis inducida pola amiodarona: úsanse altas doses de glucocorticoides.
3. Insuficiencia suprarrenal: úsase hidrocortisona ou doses alternativamente baixas ou medias de glucocorticoides como terapia de reposición.
1.A enfermidade de Crohn - no estadio agudo, úsanse altas doses de glucocorticoides.
2. Colite ulcerativa inespecífica: no estadio agudo utilízanse doses medias ou altas de glucocorticoides.
3. Hepatite autoinmune - úsanse doses medias ou altas de glucocorticoides.
4. As fases iniciais da cirrosis: aplicar a dose media de glucocorticoides.
5. Hepatite alcohólica grave: úsanse doses medias ou altas de glucocorticoides.
1.Miocardite linfocítica postviral e inespecífica: prescríbense doses medias ou altas de glucocorticoides.
2. Pericardite aguda non purulenta con acumulación de exudado: úsanse doses ou medias de glucocorticoides.
1.Asma bronquial: prescríbense glucocorticoides orais (dosificación media ou alta) para asma grave aguda, exacerbacións graves de asma, onde os glucocorticoides inhalados e broncodilatadores son ineficaces.
2. Alveolite fibrosante criptogénica: úsanse altas doses de glucocorticoides.
3. Bronquiolite obrigatoria - úsanse altas doses de glucocorticoides.
4. Sarcoidosis dos pulmóns: úsanse doses medias ou altas de glucocorticoides.
5. Neumonía eosinofílica: prescríbense doses medias ou altas de glucocorticoides.
1.Hemoblastoses: úsanse doses altas e moi altas de glucocorticoides.
2. Anemia (hemolítica, autoinmune, aplástica): úsanse doses medias e altas de glucocorticoides.
3. Trombocitopenia: prescríbense doses medias e altas de glucocorticoides.
1. Choque de varias orixes: usa altas e altas doses de glucocorticoides. É preferible a terapia por pulso.
2. Reaccións alérxicas: preséntanse doses altas e moi altas de glucocorticoides, se é necesario, "terapia de pulso".
3. Síndrome de tensión respiratoria aguda - úsanse doses moi altas de glucocorticoides.
1.Dependendo da situación clínica, utilízanse glucocorticoides de baixa a moi alta e, se é necesario, "terapia de pulso".
4.Básico enefectos secundarios dos glucocorticoides
Con cursos curtos de tratamento con glucocorticoides, xeralmente non se producen efectos secundarios graves. Algúns pacientes denuncian un aumento do apetito, aumento de peso, irritabilidade nerviosa e trastornos do sono.
Con administración prolongada de corticosteroides, o chamado síndrome de Itsenko-Cushing desenvólvese con obesidade grave, unha cara "en forma de lúa", un excesivo crecemento de pelo no corpo e un aumento da presión arterial. Cunha diminución da dose de hormonas, estes fenómenos son reversibles. O efecto máis perigoso dos glucocorticoides sobre a membrana mucosa do tracto gastrointestinal: poden provocar úlceras do duodeno e do estómago. Por iso, a presenza dun paciente con úlcera péptica é unha das principais contraindicacións para o uso de corticoides. Cando un paciente está tomando hormonas esteroides, se hai queixas de pesadez ou dor no abdome superior, azia, é necesario prescribir medicamentos que baixen a acidez do zume gástrico. O tratamento con glucocorticoides vén acompañado dunha perda de potasio, polo que tomar prednisona debe combinarse con tomar preparados de potasio (panangina, asparkum). Os corticosteroides provocan retención de sodio e fluído no corpo, polo que cando aparece edema, só se poden usar diuréticos que aforran potasio (por exemplo, triampuro, triresido K). Con administración prolongada de corticosteroides a nenos, é posible a perturbación do crecemento e a puberdade tardía.
Todos os glucocorticoides teñen efectos secundarios similares, que dependen da dose e duración do tratamento.
1. Supresión da función da corteza suprarrenal. Os glucocorticoides suprimen a función do sistema da córtex hipotálamo-hipofisaria-suprarrenal. Este efecto pode persistir durante meses despois da interrupción do tratamento e depende da dose empregada, da frecuencia de administración e da duración da terapia. O efecto sobre a córtex suprarrenal pódese debilitar se, en lugar de fármacos de acción longa (dex-metazona), se usan medicamentos de acción curta como prednisona ou metilprednisolona en pequenas doses. É recomendable tomar toda a dose diaria na madrugada, o que é máis acorde co ritmo fisiolóxico da secreción endóxena de cortisol. Cando se toman todos os días, úsanse glucocorticoides de acción curta e tamén se prescribe unha soa dose nas primeiras horas da mañá. Baixo a influencia das tensións (operacións abdominais, enfermidades concomitantes agudas graves, etc.), a hipofunción da córtex suprarrenal maniféstase a miúdo, que se manifesta por falta de apetito, perda de peso, somnolencia, febre e hipotensión ortostática. A función mineralocorticoide da cortiza suprarrenal consérvase, polo tanto, a hipercalemia e a hiponatremia, característica da insuficiencia cortical suprarrenal primaria, adoitan estar ausentes. Os pacientes deben levar unha pulseira especial ou ter unha tarxeta médica con eles para que, en caso de emerxencia, o médico saiba da necesidade de administración inmediata de glucocorticoides. En pacientes que levan varias semanas máis de 10 mg de prednisona ao día (ou unha dose equivalente doutro fármaco), un ou outro grao de supresión da córtex suprarrenal pode persistir ata un ano despois de deixar o tratamento.
2. Supresión da inmunidade.Os glucocorticoides reducen a resistencia ás infeccións, especialmente as bacterianas, o risco de infección depende directamente da dose de glucocorticoides e segue sendo a principal causa de complicacións e morte de pacientes con LES. Como resultado do tratamento con esteroides, unha infección local pode converterse en sistémica, unha infección latente pode facerse activa e os microorganismos non patóxenos tamén poden causala. No contexto da terapia con glucocorticoides, as infeccións poden producirse encubertas, pero a temperatura corporal normalmente sobe. Como medida preventiva, recoméndase a inmunización con vacinas contra a gripe e os pneumocócicos, que non provocan a exacerbación da LES. Antes de comezar o tratamento con glucocorticoides, é recomendable realizar unha proba de tuberculina na pel.
3. Os cambios de aspecto inclúen: redondeo da cara, aumento de peso, redistribución da graxa corporal, hirsutismo, acne, estriadas roxas, contusións con feridas mínimas. Estes cambios diminúen ou desaparecen despois dunha redución da dose.
4. Os trastornos mentais van desde unha irritabilidade leve, euforia e trastornos do sono ata unha depresión ou psicose grave (esta última pode considerarse erróneamente como unha lesión de lupus do sistema nervioso central).
5. A hiperglicemia pode ocorrer ou aumentar durante o tratamento con glucocorticoides, pero, por regra xeral, non serve de contraindicación para o seu nomeamento. Pode ser necesario o uso de insulina, raramente se produce cetoacidosis.
6. As violacións do equilibrio auga-electrólitos inclúen retención de sodio e hipocalemia. Dificultades particulares no tratamento xorden con insuficiencia cardíaca conxestiva e edema.
7. Os glucocorticoides poden causar ou aumentar a hipertensión arterial. A terapia de pulso de E / S con esteroides adoita agravar a hipertensión arterial preexistente se é difícil de tratar.
8. A osteopenia con fracturas de compresión dos corpos vertebrais adoita desenvolverse cunha terapia con glucocorticoides prolongada. Polo tanto, os pacientes deben recibir ións de calcio (1-1,5 g / día por vía oral). Os diuréticos con vitamina D e tiazídica poden ser de axuda. En mulleres posmenopáusicas, con maior risco de osteopenia, normalmente móstranse estróxenos, pero os resultados do seu uso en LES son contradictorios. Tamén se poden usar calcitonitas e difosfonatos. Recoméndase exercicio que estimule a osteoxénese.
9. A miopatía esteroide caracterízase por danos musculares principalmente no ombreiro e a cintura pélvica. A debilidade muscular nótase, pero non hai dor, a actividade das encimas sanguíneas de orixe muscular e parámetros electromiográficos, a diferenza do dano muscular inflamatorio, non cambian. Unha biopsia muscular realízase só en casos raros cando é necesario excluír a súa inflamación. A posibilidade de miopatía de esteroides diminúe a medida que se reduce a dose de glucocorticoides e realízase un complexo de exercicios físicos intensivos. Non obstante, a recuperación completa pode levar varios meses.
10. Os trastornos oftálmicos inclúen aumento da presión intraocular (que ás veces se debe á progresión do glaucoma) e da catarata subcapsular posterior.
11. A necrose ósea isquémica (aséptica, necrose avascular, osteonecrose) tamén pode ocorrer durante a terapia con esteroides. Estas complicacións son moitas veces múltiples, con danos na cabeza femoral e no húmero, así como na meseta da tibia. Detéctanse anomalías precoz con escintigrafía isotópica e resonancia magnética. A aparición de cambios radiolóxicos característicos indican un proceso de gran alcance. A descompresión ósea cirúrxica pode ser efectiva nas primeiras etapas da necrose isquémica, pero as estimacións deste método de tratamento son controvertidas.
12. Outros efectos secundarios dos glucocorticoides inclúen hiperlipidemia, irregularidades menstruais, aumento da sudoración, especialmente pola noite e hipertensión ben intracraneal (pseudotumor cerebri). A acción dos glucocorticoides ás veces está asociada á aparición de tromboflebite, arterite necrotizante, pancreatite e úlcera péptica, pero a evidencia desta conexión é insuficiente.
5.Golpe de avisoglucocorticoides
1. Unha fundamentación clara para o uso de glucocorticoides.
2. A elección razoada dun medicamento glucocorticoide, caracterizado tanto por alta eficiencia como por un espectro relativamente baixo de efectos secundarios. A metilprednisolona (Medrol, Solu-medrol e Depo-medrol) cumpre estes requisitos, cuxos argumentos se indican anteriormente.
3. A elección da dose inicial dun medicamento glucocorticoide que proporcione o efecto clínico necesario nas súas dosificaciones mínimas debe basearse nunha avaliación en profundidade do paciente, incluída a nosoloxía da enfermidade, a súa actividade, a presenza de danos nos órganos e sistemas vitais, así como en recomendacións xeralmente aceptadas na táctica da terapia con glucocorticoides para varias clínicas situacións. Hoxe, a terapia con glucocorticoides é recoñecida sen ambigüidade como o tratamento de elección para moitas enfermidades reumáticas, incluída a LES, dermatomiosite e polimiosite, vasculite, glomerulonefrite e moito máis. Ao mesmo tempo, as dosificaciones iniciais varían significativamente segundo as características do cadro clínico e os parámetros de laboratorio. Así, por exemplo, con alta actividade de LES, dermatomiosite, polimiosite, vasculite sistémica e / ou implicación de órganos e sistemas vitais nestas doenzas, indícase o uso de altas ou moi altas doses de glucocorticoides. Ao mesmo tempo, con baixa actividade de LES, vasculite, pódese conseguir un bo efecto clínico mediante doses baixas de glucocorticoides e, a falta de danos nos órganos internos e no sistema nervioso central, non é necesario prescribir terapia con glucocorticoides para conseguir remisión clínica, xa que se pode conseguir un efecto clínico suficiente usando AINEs , normalmente en combinación con preparacións de aminoquinolina. Ao mesmo tempo, algúns pacientes necesitan un uso adicional de doses baixas de glucocorticoides (Medrol 4-6 mg ao día ou prednisolona 5-7,5 mg por día).
O uso xeneralizado de fármacos modificadores da enfermidade xa nas etapas iniciais da artrite reumatoide, a falta de datos sobre os efectos positivos das doses medias e altas de glucocorticoides sobre o prognóstico a longo prazo en pacientes con artrite reumatoide e o alto risco de efectos secundarios graves ao usalos, cambiaron significativamente os enfoques sobre o uso de glucocorticoides. Hoxe a falta
Non se recomenda unha manifestación extraarticular de artrite reumatoide (por exemplo, vasculite, pneumonite) para o uso de glucocorticoides en doses superiores a 7,5 mg ao día de prednisona ou 6 mg de metilprednisolona. Ademais, en moitos pacientes con artrite reumatoide, a adición de 2-4 mg por día de Medrol á terapia modificadora da enfermidade caracterízase por un bo efecto clínico.
1. Estableza unha técnica para tomar glucocorticoides: opcións continuas (diarias) ou intermitentes (alternativas e intermitentes).
2. Na maioría das enfermidades reumáticas, a vasculite, a glomerulonefrite, os glucocorticoides normalmente non son suficientes para lograr unha remisión clínica e de laboratorio completa ou parcial, o que require a súa combinación con varios fármacos citotóxicos (azatioprina, ciclofosfamida, metotrexato e outros). Ademais, o uso de citostáticos pode reducir significativamente a dosificación de glucocorticoides (ou incluso cancelalos) mantendo o efecto clínico obtido, o que reduce significativamente a frecuencia e gravidade dos efectos secundarios da terapia con glucocorticoides.
3. Moitos clínicos recomendan que se continúen en moitos pacientes con enfermidades reumáticas unha dose moi baixa de glucocorticoides (2-4 mg / día de Medrol® ou 2,5-5,0 mg / día de prednisolona) a longo prazo despois de lograr unha remisión clínica e de laboratorio.
Conlista de literatura usada
1 conferencia MD, prof. Lobanova E.G., doutoramento Chekalina N.D.