O papel das proteínas no corpo humano

A gran importancia das proteínas para o corpo débese ás súas funcións.
As funcións básicas das proteínas presentadas ilustran a importancia desta clase de substancias para garantir a vida humana normal.
No século XIX, os científicos declararon:
- os corpos proteicos son únicos, a esencia da vida,
- necesítase un metabolismo constante entre os seres vivos e o ambiente.
Estas disposicións seguen sen cambios ata o momento.
A composición básica das proteínas
As enormes unidades moleculares dunha proteína simple chamada proteína están formadas por pequenos bloques conectados químicamente - aminoácidos con fragmentos idénticos e diferentes. Tales composicións estruturais denomínanse heteropolímeros. Só 20 representantes da clase de aminoácidos sempre se atopan nas proteínas naturais. A composición básica das proteínas caracterízase pola presenza obrigatoria de carbono - C, nitróxeno - N, hidróxeno - H, osíxeno - O. Xofre - S. En proteínas complexas chamadas proteidas, tamén se conteñen outras substancias ademais de residuos de aminoácidos. Así, o fósforo - P, cobre - Cu, ferro - Fe, iodo - I, selenio - Se poden estar na súa composición.
Os ácidos aminoocarboxílicos das proteínas naturais clasifícanse por estrutura química e importancia biolóxica. A clasificación química é importante para os químicos, biolóxicos, para todos.
No corpo humano sempre hai dous fluxos de transformacións:
- a repartición, a oxidación, a eliminación de produtos alimenticios,
- síntese biolóxica de novas substancias esenciais.
12 aminoácidos que sempre se atopan nas proteínas naturais pódense crear mediante síntese biolóxica do corpo humano. Chámanse intercambiables.
Os aminoácidos nunca se sintetizan en humanos. Son imprescindibles, débense dar regularmente con comida.
Segundo a presenza de ácidos amino-carboxílicos esenciais, as proteínas divídense en dúas clases.
- As proteínas completas teñen todos os aminoácidos necesarios polo corpo humano. O conxunto requirido de aminoácidos esenciais contén proteínas de queixo, produtos lácteos, aves de curral, carne de vacún, mar e peixes de auga doce, ovos.
- En proteínas defectuosas, poden faltar un ou varios ácidos importantes. Estes inclúen proteínas vexetais.
Para avaliar a calidade das proteínas da dieta, a comunidade do mundo médico compáraas cunha proteína "ideal", que verificou estrictamente proporcións de aminoácidos esenciais esenciais e esenciais. Na natureza, non existe unha proteína "ideal". Tan preto del como as proteínas animais. As proteínas vexetais a miúdo non son suficientes para a concentración normativa dun ou máis aminoácidos. Se se engade a sustancia que falta, a proteína quedará completa.
As principais fontes de proteínas de orixe vexetal e animal
Na comunidade científica doméstica dedicada a un estudo completo da química dos alimentos, destaca un grupo de profesores A.P. Nechaev, os seus compañeiros e estudantes. O equipo determinou o contido de proteína nos principais produtos alimentarios dispoñibles no mercado ruso.
- Importante! As figuras identificadas informan sobre o contido de proteína en 100 g do produto, liberadas da parte non comestible.
- A maior cantidade de proteína atópase na soia, sementes de cabaza e cacahuetes (34,9 - 26,3 g).
- Valores de 20 a 30 gramos atópanse en chícharos, feixóns, pistachos e sementes de xirasol.
- Améndoas, anacardos, abelás caracterízanse por números de 15 a 20 gr.
- As noces, a pasta, a maioría dos cereais (excepto o arroz, os grans de millo) conteñen de 10 a 15 gramos de proteína por cada 100 gramos de produto.
- O arroz, as tixolas de millo, o pan, o allo e os albaricoques secos inclúen entre os 5 e os 10 gr.
- En 100 gramos de repolo, cogomelos, patacas, ameixas, algunhas variedades de remolacha, o contido en proteínas é de 2 a 5 gramos.
- As pasas, os rábanos, as cenorias, os pementos doces teñen pouca proteína, os seus indicadores non superan os 2 gramos.
Se non puideses atopar un obxecto vexetal aquí, a concentración de proteínas nela é demasiado baixa ou non está en absoluto. Por exemplo, nos zumes de froitas hai moi pouca proteína, nos aceites vexetais naturais, en absoluto.
- A concentración máxima de proteínas atopouse en queixo de peixe, queixos duros e procesados e carne de coello (de 21,1 a 28,9 g).
- Un gran número de produtos contén de 15 a 10 gramos de proteína. Trátase de paxaro, peixe mariño (excepto a capelina), carne de gando, camarón, calamar, queixo cottage, queixo feta, peixe de auga doce.
- Capelina, ovo de polo, carne de porco conteñen entre 12,7 e 15 gramos de proteína por cada 100 gramos de produto.
- Iogur, queixo de cuajada caracterízanse polos números 5 - 7,1 gr.
- Leite, kefir, leite cocido fermentado, crema de leite, nata conteñen de 2,8 a 3 gramos de proteína.
A información sobre as principais fontes de proteínas de orixe vexetal e animal en produtos que se someteron a procesamento tecnolóxico en varias etapas (guiso, embutidos, xamón, salchichas) non é de interese. Non se recomenda para unha alimentación saudable regular. Non é significativo o uso a curto prazo destes produtos.
O papel da proteína na nutrición
Como resultado de procesos metabólicos no corpo, fórmanse constantemente novas moléculas de proteínas, en vez das antigas. A taxa de síntese en distintos órganos non é a mesma. As proteínas hormonais, por exemplo, a insulina, restáranse (resintetizáronse) moi rapidamente, en horas, minutos. As proteínas do fígado, as mucosas intestinais rexenéranse en 10 días. As moléculas proteicas do cerebro, os músculos, o tecido conxuntivo restáurase a máis longa, a síntese restauradora (resíntese) pode durar ata seis meses.
O proceso de utilización e síntese caracterízase por un balance de nitróxeno.
- Nunha persoa formada con plena saúde, o saldo de nitróxeno é cero. Neste caso, a masa total de nitróxeno subministrada con proteínas durante a nutrición é igual á masa excretada con produtos de descomposición.
- Os organismos mozos están a desenvolverse rapidamente. O balance de nitróxeno é positivo. Hai moita proteína, menos se excreta.
- No envellecemento, enfermos, o saldo de nitróxeno é negativo. A masa de nitróxeno liberada con produtos metabólicos é maior que a recibida coa inxestión de alimentos.
O papel da proteína na nutrición é proporcionarlle a unha persoa a cantidade necesaria de compoñentes de aminoácidos adecuados para a participación nos procesos bioquímicos do corpo.
Para garantir un metabolismo normal, é importante saber canto proteína necesita consumir unha persoa ao día.
Os fisiólogos domésticos e estadounidenses recomendan comer 0,8 - 1 g de proteína por 1 kg de peso humano. Os números son bastante medianos. A cantidade depende da idade, natureza do traballo, estilo de vida dunha persoa. De media, recomendan consumir de 60 gramos a 100 gramos de proteína ao día. Para os homes que se dedican a un traballo físico, a norma pódese aumentar ata os 120 gramos por día. Para os que están sometidos a cirurxía, enfermidades infecciosas, a norma tamén aumenta a 140 gramos por día. Os diabéticos son dietas recomendadas cun alto contido en proteínas, que poden chegar aos 140g por día. As persoas con trastornos metabólicos, tendencia á gota, deben consumir menos proteínas. A norma para eles é de 20 - 40 gramos por día.
Para as persoas que participan en deportes activos que aumentan a masa muscular, a norma aumenta significativamente, pode alcanzar 1,6-1,8 gramos por 1 kg de peso do atleta.
- Importante! É recomendable que o adestrador aclare a resposta á pregunta: cantas proteínas deben consumirse ao día durante o exercicio. Os profesionais teñen información sobre os custos de enerxía para todo tipo de adestramento, formas de manter o funcionamento normal do corpo do atleta.
Para a aplicación de todas as funcións fisiolóxicas, é importante non só a presenza de aminoácidos esenciais na proteína, senón tamén a eficiencia da súa asimilación. As moléculas proteicas teñen diferentes niveis de organización, solubilidade, grao de accesibilidade aos encimas dixestivos. O 96% das proteínas do leite, os ovos descompoñense de forma eficaz. En carne, o peixe, un 93-95% das proteínas son dixeridas con seguridade. A excepción son as proteínas da pel e do cabelo. Os produtos vexetais que conteñen proteínas dixéranse nun 60-80%. Nos vexetais, o 80% das proteínas absorbense, nas patacas - o 70%, no pan - do 62 ao 86%.
A porción recomendada de proteínas procedentes de fontes animais debe ser do 55% da cantidade total de masa proteica.
- A deficiencia de proteínas no corpo leva a importantes cambios metabólicos. Tales patoloxías chámanse distrofia, kwashiorkor. Por primeira vez, revelouse unha violación nos habitantes das tribos salvaxes de África, caracterizada por un saldo negativo de nitróxeno, unha función intestinal prexudicada, unha atrofia muscular, un atropelo. A deficiencia parcial de proteína pode ocorrer con síntomas similares, que poden ser leves durante algún tempo. Especialmente perigosa é a falta de proteínas no corpo do neno. Tales trastornos dietéticos poden provocar a inferioridade física e intelectual dunha persoa en crecemento.
- O exceso de proteína no corpo sobrecarga o sistema excretor. A carga nos riles aumenta. Con patoloxías existentes no tecido renal, o proceso pode agravarse. É moi malo se un exceso de proteínas no corpo vai acompañado dunha falta doutros compoñentes alimentarios valiosos. Antigamente, nos países de Asia había un método de execución, no que o condenado alimentábase só de carne. Como resultado, o delincuente morreu pola formación de produtos de podremia no intestino, tras esta intoxicación.
Un enfoque razoable para proporcionarlle ao corpo proteínas garante o funcionamento eficaz de todos os sistemas de vida.
Historia do estudo

A proteína foi obtida por primeira vez (en forma de glute) en 1728 polo italiano Jacopo Bartolomeo Beccari a partir de fariña de trigo. As proteínas foron illadas nunha clase separada de moléculas biolóxicas no século XVIII como resultado do traballo do químico francés Antoine de Fourcroix e outros científicos que observaron a propiedade das proteínas de coagular (desnaturalizar) baixo a influencia do calor ou dos ácidos. Naquel momento, investigáronse proteínas como a albúmina ("clara de ovo"), a fibrina (proteína do sangue) e o glute dos grans de trigo.
A comezos do século XIX, xa se obtivo información sobre a composición elemental das proteínas, sabíase que os aminoácidos fórmanse durante a hidrólise das proteínas. Algúns destes aminoácidos (por exemplo, glicina e leucina) xa se caracterizaron. A partir dunha análise da composición química das proteínas, o químico holandés Gerrit Mulder hipotetizou que case todas as proteínas teñen unha fórmula empírica similar. En 1836, Mulder propuxo o primeiro modelo da estrutura química das proteínas. Baseándose na teoría dos radicais, el tras varios refinamentos chegou á conclusión de que a unidade estrutural mínima dunha proteína ten a seguinte composición: C40H62N10O12. Chamou a esta unidade "proteína" (Pr) (do grego. Protos - o primeiro, primario), e á teoría - "teoría de proteínas". O propio termo "proteína" foi proposto polo químico sueco Jacob Berzelius. Segundo Mulder, cada proteína está composta por varias unidades proteicas, xofre e fósforo. Por exemplo, suxeriu escribir a fórmula da fibrina como 10PrSP. Mulder tamén estudou os produtos da destrución de proteínas - aminoácidos e para un deles (leucina) cunha pequena fracción de erro, determinou o peso molecular - 131 daltons. Coa acumulación de novos datos sobre as proteínas, a teoría da proteína comezou a ser criticada, pero, a pesar disto, ata finais dos anos 1850 aínda se consideraba universalmente recoñecida.
A finais do século XIX investigáronse a maioría dos aminoácidos que compoñen as proteínas. A finais da década de 1880. Científico ruso A. Ya.Danilevsky observou a existencia de grupos péptidos (CO - NH) na molécula de proteína. En 1894, o fisiólogo alemán Albrecht Kossel presentou unha teoría segundo a cal os aminoácidos son os principais elementos estruturais das proteínas. A principios do século XX, o químico alemán Emil Fischer probou experimentalmente que as proteínas consisten en residuos de aminoácidos conectados por enlaces peptídicos. Tamén realizou a primeira análise da secuencia de aminoácidos da proteína e explicou o fenómeno da proteólise.
Non obstante, o papel central das proteínas nos organismos non se recoñeceu ata 1926, cando o químico estadounidense James Sumner (despois Premio Nobel de Química) demostrou que o enzima urease é unha proteína.
A dificultade para illar as proteínas puras dificultaba o estudo. Polo tanto, os primeiros estudos realizáronse empregando aqueles polipéptidos que se podían purificar facilmente en grandes cantidades, é dicir, proteínas sanguíneas, ovos de polo, varias toxinas, así como encimas dixestivas / metabólicas secretadas despois do sacrificio de gando. A finais dos anos 50, a compañía Armor Hot Dog Co. conseguiu limpar un quilogramo de ribonuclease A pancreática bovina A, que se converteu nun obxectivo experimental para moitos estudos.
A idea de que a estrutura secundaria das proteínas é o resultado da formación de enlaces de hidróxeno entre residuos de aminoácidos foi proposta por William Astbury en 1933, pero Linus Pauling é considerado o primeiro científico que foi capaz de predicir con éxito a estrutura secundaria das proteínas. Máis tarde, Walter Kauzman, apoiándose no traballo de Kai Linnerstrom-Lang, contribuíu significativamente á comprensión das leis da formación da estrutura terciaria das proteínas e do papel das interaccións hidrofóbicas neste proceso. A finais dos anos 40 e principios dos anos 50, Frederick Senger desenvolveu un método para secuenciar proteínas, mediante o cal determinou a secuencia de aminoácidos de dúas cadeas de insulina en 1955, demostrando que as proteínas son polímeros lineais de aminoácidos e non ramificadas (como algúns azucres. ) cadeas, coloides ou cicloles. A primeira proteína, cuxa secuencia de aminoácidos foi establecida por científicos soviéticos / rusos, foi en 1972 aspartate aminotransferase.
As primeiras estruturas espaciais de proteínas obtidas por difracción de raios X (análise de difracción de raios X) coñecéronse a finais dos anos cincuenta e principios dos anos 1960, e as estruturas descubertas por resonancia magnética nuclear na década de 1980. En 2012, o Banco de Datos de Proteínas contiña aproximadamente 87.000 estruturas proteicas.
No século XXI, a investigación sobre proteínas mudouse a un nivel cualitativamente novo, cando non só se estudan as proteínas purificadas individuais, senón tamén o cambio simultáneo do número e modificacións post-translacionais dun gran número de proteínas de células individuais, tecidos ou organismos enteiros. Esta área de bioquímica chámase proteómica. Usando métodos de bioinformática, fíxose posible non só procesar os datos da análise de difracción de raios X, senón tamén predicir a estrutura da proteína en función da súa secuencia de aminoácidos. Na actualidade, a microscopía crioelectrónica de complexos proteicos grandes e a predición das estruturas espaciais dos dominios proteicos mediante programas informáticos están achegando á precisión atómica.

O tamaño das proteínas pódese medir en termos de residuos de aminoácidos ou en daltóns (peso molecular), pero debido ao tamaño relativamente grande da molécula, a masa proteica exprésase en unidades derivadas - kilodaltóns (kDa). As proteínas de levadura, en media, consisten en 466 residuos de aminoácidos e teñen un peso molecular de 53 kDa. A proteína máis grande coñecida actualmente - titina - é un compoñente dos sarcomeres musculares, o peso molecular das súas diversas variantes (isoformas) varía no rango de 3000 a 3700 kDa. A titina do músculo soleus (lat. Soleus) dunha persoa está composta por 38.138 aminoácidos.
Anfotericidade
As proteínas teñen a propiedade da anfotericidade, é dicir, segundo as condicións, presentan propiedades ácidas e básicas. Nas proteínas, hai varios tipos de grupos químicos capaces de ionizar nunha solución acuosa: residuos de ácido carboxílico das cadeas laterais de aminoácidos ácidos (ácidos asparticos e glutámicos) e grupos que conteñen nitróxeno das cadeas laterais de aminoácidos básicos (principalmente o grupo ε-amino da lisina e o residuo de amidina CNH (NH)2) arginina, en menor medida - o residuo de histidina imidazol). Cada proteína caracterízase por un punto izoeléctrico (pI) - acidez media (pH), na que a carga eléctrica total das moléculas desta proteína é cero e, en consecuencia, non se moven no campo eléctrico (por exemplo, por electroforese). No punto isoeléctrico, a hidratación e a solubilidade da proteína son mínimas. O valor pI depende da relación de residuos de aminoácidos básicos e ácidos nunha proteína: en proteínas que conteñen moitos residuos de aminoácidos ácidos, os puntos izoeléctricos están na rexión ácida (tales proteínas chámanse ácidas) e en proteínas que conteñen máis residuos básicos na rexión alcalina (proteínas básicas ) O valor pI desta proteína tamén pode variar en función da forza iónica e do tipo de solución tampón na que se atopa, xa que as sales neutras afectan o grao de ionización dos grupos químicos da proteína. A pI dunha proteína pódese determinar, por exemplo, a partir dunha curva de valoración ou por focalización isoeléctrica.
En xeral, o pI dunha proteína depende da función que desempeñe: o punto isoeléctrico da maioría das proteínas dos tecidos vertebrados oscila entre 5,5 e 7,0, pero nalgúns casos os valores están en zonas extremas: por exemplo, para a pepsina, unha encima proteolítica dun gástrico fortemente ácido zume pI
1, e para o salmón - a proteína proteína do leite de salmón, cuxa característica é un alto contido en arginina - pI
12. As proteínas que se unen a ácidos nucleicos por interacción electrostática con grupos fosfatos son moitas veces as principais proteínas. Un exemplo de tales proteínas son as histonas e as protaminas.
Que son as proteínas?
As proteínas son compostos orgánicos complexos de alto peso molecular constituídos por residuos de aminoácidos, combinados dun xeito especial. Cada proteína ten a súa propia secuencia de aminoácidos individual, a súa localización no espazo. É importante comprender que as proteínas que entran no corpo non son absorbidas por elas de forma inalterada, se descompoñen en aminoácidos e coa súa axuda o corpo sintetiza as súas proteínas.
22 aminoácidos participan na formación de proteínas, 13 deles pódense converter uns en outros, 9 - fenilalanina, triptófano, lisina, histidina, treonina, leucina, valina, isoleucina, metionina - son insubstituíbeis. A falta de ácidos insubstituíbeis no corpo é inaceptable, isto levará a perturbación do corpo.
É importante non só o feito de que a proteína entre no corpo, senón tamén en que aminoácidos consiste.

Que é a proteína?
Proteínas (proteínas / polipéptidos): substancias orgánicas, polímeros naturais que conteñen vinte aminoácidos relacionados. As combinacións fornecen moitos tipos. O corpo afronta a síntese de doce aminoácidos intercambiables.
Oito dos vinte aminoácidos esenciais que se atopan na proteína non poden ser sintetizados polo corpo por si mesmos, obtéñense con alimentos. Trátase de valina, leucina, isoleucina, metionina, triptófano, lisina, treonina, fenilalanina, importantes para a vida.
Que pasa proteína
Distingue entre animais e vexetais (por orixe). Precísanse dous tipos de consumo.
Animal:
A branca de ovo é facilmente e case completamente absorbida polo corpo (90-92%). As proteínas dos produtos lácteos fermentados son lixeiramente peores (ata o 90%). As proteínas de leite integral fresco absorbense aínda menos (ata o 80%).
O valor da carne e do peixe na mellor combinación de aminoácidos esenciais.
Vexetal:
A soia, a canola e o algodón teñen unha boa relación de aminoácidos para o corpo. Nos cultivos, esta relación é máis débil.
Non hai ningún produto cunha relación de aminoácidos ideal. Unha nutrición adecuada implica unha combinación de proteínas animais e vexetais.
A base da nutrición "polas regras" é a proteína animal. É rico en aminoácidos esenciais e proporciona unha boa absorción de proteínas vexetais.
Funcións proteicas no corpo
Estando nas células do tecido, cumpre moitas funcións:
- Protectora. O funcionamento do sistema inmunitario é a neutralización de substancias estranxeiras. Prodúcese anticorpos.
- Transporte. A subministración de diversas substancias, por exemplo, a hemoglobina (subministración de osíxeno).
- Reguladora. Manter un fondo hormonal.
- Propulsión. Todos os tipos de movemento proporcionan actina e miosina.
- Plástico. O estado do tecido conectivo está controlado polo contido de coláxeno.
- Catalítica. É un catalizador e acelera o paso de todas as reaccións bioquímicas.
- Conservación e transmisión de información xénica (moléculas de ADN e ARN).
- Enerxía. A subministración de enerxía de todo o corpo.
Outros proporcionan respiración, son os responsables da dixestión dos alimentos, regulan o metabolismo. A proteína fotosensible da rodopsina é a responsable da función visual.
Os vasos sanguíneos conteñen elastina, grazas a ela funcionan completamente. A proteína fibrinóxena proporciona coagulación do sangue.
Síntomas dunha falta de proteínas no corpo
A deficiencia de proteínas é bastante frecuente coa desnutrición e un estilo de vida hiperactivo dunha persoa moderna. De forma leve exprésase en fatiga regular e mal rendemento. Con un aumento de cantidades insuficientes, o corpo asina por síntomas:
- Debilidade e mareos xerais. Diminución do estado de ánimo e da actividade, aparición de fatiga muscular sen esforzo físico especial, coordinación deteriorada dos movementos, debilitamento da atención e memoria.
- Dores de cabeza e empeoramento do sono. O insomnio e ansiedade resultantes indican unha falta de serotonina.
- Os cambios de humor frecuentes, gruñidos. A falta de enzimas e hormonas provoca o esgotamento do sistema nervioso: irritabilidade por calquera motivo, agresividade pouco razoable, contención emocional.
- A pel pálida, erupcións cutáneas. A falta de proteína que contén ferro, desenvólvese anemia, cuxos síntomas son a sequedad e palidez da pel, as mucosas.
- Hinchazón das extremidades. Un baixo contido en proteínas no plasma altera o equilibrio auga-sal. A graxa subcutánea acumula fluído nos nocellos e nocellos.
- Curación deficiente de feridas e abrasións. A reparación celular está inhibida por falta de "material de construción".
- Fraxilidade e perda de cabelo, fraxilidade das uñas. A aparición de caspa debido á pel seca, a exfoliación e a fisuración da placa das uñas é o sinal máis común do corpo sobre a falta de proteínas. O pelo e as uñas están en constante crecemento e responden instantaneamente a unha falta de substancias que promoven o crecemento e o bo estado.
- Perda de peso razoable. A desaparición de quilogramos sen motivo aparente débese á necesidade do corpo de compensar a falta de proteínas debido á masa muscular.
- Falla do corazón e dos vasos sanguíneos, aparición de falta de respiración. Os sistemas respiratorio, dixestivo e xenitourinario tamén se están deteriorando. A dispnea aparece sen esforzo físico, tose sen arrefriados e enfermidades virais.
Coa aparición de síntomas deste tipo, ten que cambiar inmediatamente o réxime e a calidade dos alimentos, reconsiderar o seu estilo de vida e, se está agravado, consulte a un médico.
Canta cantidade de proteína é necesaria para a asimilación
A taxa de consumo por día depende da idade, sexo, tipo de traballo. Os datos sobre as normas preséntanse na táboa (a continuación) e están deseñados para o peso normal.
Triturar a inxestión de proteínas varias veces é opcional. Cada un determina unha forma conveniente para si mesmo, o principal é manter a taxa de inxestión diaria.
| Actividade laboral + |
actividade física
Alto contido en proteínas nos alimentos
Alimentos recoñecidos que conteñen proteínas:
De todas as variedades de carne, o primeiro lugar despois do contido de aves será de vacún: 18,9 g. Despois, carne de porco: 16,4 g, cordeiro: 16,2 g.
O marisco e o calamar son os líderes: 18,0 g.
O peixe máis rico en proteínas é o salmón: 21,8 g, despois o salmón rosa: 21 g, o zandro: 19 g, a caballa: 18 g, arengada: 17,6 g e o bacallau: 17,5 g.
Entre os produtos lácteos, o kefir e a crema azedo manteñen firmemente a posición: 3,0 g, despois o leite: 2,8 g.
Grans altos - Hércules: 13,1 g, mill: 11,5 g, sêmola: 11,3 g
Coñecendo a norma e tendo en conta as oportunidades financeiras, podes escribir correctamente un menú e asegúrate de complementalo con graxas e hidratos de carbono.
A relación de proteínas na nutrición
A proporción de proteínas, graxas e carbohidratos nunha dieta sa debe ser (en gramos) 1: 1: 4. A clave do equilibrio dun prato saudable pódese representar doutro xeito: proteínas do 25-35%, graxas do 25-35%, carbohidratos do 30-50%.
Ao mesmo tempo, as graxas deberían ser útiles: aceite de oliva ou linaza, noces, peixes, queixo.
Os carbohidratos nun prato son pastas duras, calquera verduras frescas, así como froitas / froitos secos, produtos lácteos azedo.
Opcionalmente pódense combinar proteínas por racións: vexetais + animais.
Aminoácidos contidos en proteínas
O intercambiable pode ser sintetizado polo propio corpo, pero a súa subministración desde o exterior nunca é superfluo. Especialmente cun estilo de vida activo e un gran esforzo físico.
Todos sen excepción son importantes, o máis popular deles:
Alanina.
Estimula o metabolismo dos carbohidratos, axuda a eliminar as toxinas. Responsable de "limpeza". Alto contido en carne, peixe, produtos lácteos.
Arginina.
É necesario contraer músculos, pel sa, cartilaxe e articulacións. Ofrece queima de graxa e función do sistema inmune. Está en calquera carne, leite, calquera noces, xelatina.
Ácido aspartico.
Ofrece un balance enerxético. Mellora a funcionalidade do sistema nervioso central. Pois repor o recurso enerxético de carne de vacún e polo, leite, azucre de cana. Contido en patacas, noces, cereais.
Histidina.
O principal "constructor" do corpo transfórmase en histamina e hemoglobina. Cura rapidamente as feridas, é responsable dos mecanismos de crecemento. Relativamente moito en leite, cereais e calquera carne.
Serena
Neurotransmisor, indispensable para o funcionamento claro do cerebro e do sistema nervioso central. Hai cacahuetes, carne, cereais, soia.
Cunha nutrición adecuada e o xeito de vida correcto, todos os aminoácidos aparecerán no corpo para a síntese de "cubos" e o modelo de saúde, beleza e lonxevidade.
O que causa unha falta de proteínas no corpo
- Frecuentes enfermidades infecciosas, debilitamento do sistema inmunitario.
- Estrés e ansiedade.
- Envellecemento e desaceleración de todos os procesos metabólicos.
- Un efecto secundario do uso de medicamentos individuais.
- Fallos no tracto dixestivo.
- Lesións.
- Alimentación a base de comida rápida, produtos instantáneos, produtos semi-acabados de baixa calidade.
A deficiencia dun só aminoácido deterá a produción dunha proteína específica. O corpo está organizado no principio de "encher os baleiros", polo que os aminoácidos que faltan extraeranse doutras proteínas. Esta "reconstrución" perturba o funcionamento de órganos, músculos, corazón, cerebro e posteriormente provoca a enfermidade.
A deficiencia de proteínas nos nenos inhibe o crecemento, provoca discapacidades físicas e mentais.
O desenvolvemento de anemia, a aparición de enfermidades da pel, a patoloxía do tecido óseo e muscular non é unha lista completa de enfermidades. Distrofia grave de proteínas pode producir locura e kwashiorkor (tipo de distrofia grave por falta de proteínas).
Cando a proteína prexudica o corpo
- exceso de recepción
- enfermidades crónicas do fígado, riles, corazón e vasos sanguíneos.
O abastecemento excesivo non ocorre a miúdo debido á absorción incompleta dunha sustancia polo corpo.Ocorre en aqueles que queren aumentar o músculo canto antes sen seguir as recomendacións de adestradores e nutricionistas.
Os problemas de acollida "en exceso" inclúen:
Insuficiencia renal. Cantidades excesivas de órganos de sobrecarga de proteínas, perturbando a súa función natural. "Filtro" non pode facer fronte á carga, aparece unha enfermidade renal.
Enfermidade do fígado. O exceso de proteína acumula amoníaco no sangue, o que empeora a condición do fígado.
O desenvolvemento da aterosclerose. A maioría dos produtos animais, ademais de substancias útiles, conteñen graxa e colesterol nocivos.
As persoas que padecen patoloxía do fígado, riles, sistemas cardiovasculares e dixestivos deben limitar a inxestión de proteínas.
O coidado para a súa propia saúde é recompensado de bonito para os que se preocupan. Para evitar consecuencias graves, debes recordar a necesidade do corpo para a recuperación. Un descanso completo, nutrición, especialistas en visita prolongará a mocidade, a saúde e a vida.
Solubilidade
As proteínas varían na solubilidade na auga. As proteínas solubles en auga chámanse albúmina, incluídas as proteínas do sangue e do leite. Entre as insolventes ou as escleroproteínas inclúense, por exemplo, a queratina (a proteína que compón o pelo, o pelo dos mamíferos, as plumas das aves, etc.) e a fibroina, que forma parte da seda e das telas. A solubilidade dunha proteína non está determinada só pola súa estrutura, senón por factores externos, como a natureza do disolvente, a forza iónica e o pH da disolución.
As proteínas divídense tamén en hidrófilos (solubles en auga) e hidrofóbicos (hidrofugantes). A maioría das proteínas do citoplasma, núcleo e sustancia intercelular, incluíndo a queratina insoluble e a fibroína, son hidrofílicas. A maioría das proteínas que compoñen as membranas biolóxicas son proteínas integrais hidrofóbicas que interaccionan cos lípidos hidrofóbicos da membrana (estas proteínas, por regra xeral, teñen tamén sitios hidrofílicos).
Biosíntese de proteínas no corpo
Biosíntese de proteínas - a formación no corpo das proteínas desexadas a partir de aminoácidos combinándoas cun tipo especial de enlace químico - a cadea polipeptídica. O ADN almacena información sobre a estrutura das proteínas. A síntese ten lugar nunha parte especial da célula chamada ribosoma. O ARN transfire información do xen desexado (sitio do ADN) ao ribosoma.
Dado que a biosíntese proteica é complexa, usa varias informacións baseadas na existencia do ADN: a súa síntese química é unha tarefa difícil. Os científicos aprenderon como obter inhibidores de determinados encimas e hormonas, pero a tarefa científica máis importante é obter proteínas usando a enxeñaría xenética.

Transporte
A función de transporte dunha proteína especial no sangue: a hemoglobina. Grazas a esta proteína, o osíxeno é entregado dos pulmóns aos órganos e tecidos do corpo.
Consiste na actividade de proteínas do sistema inmunitario chamados anticorpos. Son anticorpos que protexen a saúde do corpo, protexéndoo de bacterias, virus, venenos e permiten que o sangue forme un coágulo no lugar dunha ferida aberta.
A función do sinal das proteínas é transmitir sinais (información) entre as células.
Normas proteicas para un adulto
A necesidade do corpo humano de proteínas depende directamente da súa actividade física. Canto máis nos movemos, máis rápidamente se producen todas as reaccións bioquímicas no noso corpo. As persoas que exercen regularmente necesitan case o dobre de proteínas que a persoa media. A falta de proteína para as persoas que participan nos deportes é perigoso "secar" os músculos e esgotar todo o corpo.
En media, a norma de proteína para un adulto calcúlase sobre a base dun coeficiente de 1 g de proteína por 1 kg de peso, é dicir, aproximadamente 80-100 g para os homes, de 55 a 60 g para as mulleres. Os atletas masculinos aconséllanse aumentar a cantidade de proteínas consumidas a 170-200 g por día.

Nutrición proteica adecuada para o corpo
Unha nutrición adecuada para saturar o corpo con proteínas é unha combinación de proteínas animais e vexetais. O grao de asimilación das proteínas dos alimentos depende da súa orixe e do método de tratamento térmico.
Así, aproximadamente o 80% do consumo total de proteínas animais e o 60% de proteína vexetal son absorbidos polo organismo. Os produtos de orixe animal conteñen unha cantidade maior de proteína por unidade de masa do produto que en vexetais. Ademais, a composición de produtos "animais" inclúe todos os aminoácidos e considéranse inferiores os produtos vexetais ao respecto.
Normas nutricionais básicas para unha mellor absorción de proteínas:
- Un xeito suave de cociñar: cociñar, cocer ao vapor, cocer. Debería descartarse a frita.
- Recoméndase comer máis peixe e aves. Se realmente queres carne, escolle carne.
- Os caldos deben excluírse da dieta, son graxos e nocivos. En casos extremos, podes cociñar o primeiro prato usando o "caldo secundario".
Características da nutrición proteica para o crecemento muscular
Os atletas que están gañando activamente masa muscular deberán cumprir todas as recomendacións anteriores. A maior parte da súa dieta debe ser proteínas de orixe animal. Débense comer xunto con produtos proteicos vexetais, dos cales a soia é unha preferencia particular.
Tamén é necesario consultar un médico e considerar a utilización de bebidas proteicas especiais, cuxa porcentaxe de absorción de proteínas é do 97-98%. O especialista seleccionará individualmente unha bebida, calculará a dosificación correcta. Este será un complemento proteico agradable e útil para o adestramento de forza.
Desnaturalización
A desnaturalización de proteínas refírese a calquera cambio na súa actividade biolóxica e / ou propiedades fisicoquímicas asociadas á perda dunha estrutura cuaternaria, terciaria ou secundaria (ver a sección "Estrutura proteica"). Por regra xeral, as proteínas son bastante estables nesas condicións (temperatura, pH, etc.) nas que normalmente funcionan no corpo. Un forte cambio nestas condicións leva á desnaturalización das proteínas. Dependendo da natureza do axente desnaturalizante, distínguense a desnaturalización mecánica (axitación forte ou axitación), física (calefacción, refrixeración, irradiación, sonicación) e química (ácidos e alcalinos, tensioactivos, urea).
A desnaturalización das proteínas pode ser completa ou parcial, reversible ou irreversible. O caso máis famoso de desnaturalización de proteínas irreversibles na vida cotiá é a preparación dun ovo de polo, cando, baixo a influencia da alta temperatura, a ovalbumina transparente soluble en auga se fai densa, insoluble e opaca. Nalgúns casos a desnaturalización é reversible, como no caso da precipitación de proteínas solubles en auga empregando sales de amonio (método de salgadura), e este método úsase como forma de limpalas.
As moléculas de proteína son polímeros lineais consistentes en residuos de α-L-aminoácidos (que son monómeros), e tamén se poden incluír residuos de aminoácidos modificados e compoñentes de natureza non aminoácida na composición de proteínas. Na literatura científica úsanse abreviaturas dunha ou tres letras para referirse a aminoácidos. Aínda que a primeira vista pode parecer que o uso de "só" 20 tipos de aminoácidos na maioría das proteínas limita a diversidade de estruturas proteicas, de feito, o número de opcións dificilmente se pode sobreestimar: para unha cadea de 5 residuos de aminoácidos, xa supera os 3 millóns e unha cadea de 100 residuos de aminoácidos. (pequenas proteínas) pódense representar en máis de 10.130 variantes. A miúdo chámanse proteínas de 2 a varias decenas de residuos de aminoácidos péptidos, cun maior grao de polimerización - esquíos, aínda que esta división é moi arbitraria.
Cando a proteína está formada como resultado da interacción do grupo α-carboxilo (-COOH) dun aminoácido co grupo α-amino (-NH2) doutro aminoácido fórmanse enlaces peptídicos. Os extremos da proteína chámanse termos N- e C, dependendo de cal dos grupos do residuo de aminoácido terminal é libre: -NH2 ou -COOH, respectivamente. En síntese de proteínas no ribosoma, o primeiro (N-terminal) residuo de aminoácido adoita ser o residuo de metionina, e os residuos posteriores únense ao C-terminal do anterior.
Características da nutrición proteica, dieters
Aqueles que queiran perder peso deben comer produtos proteicos animais e vexetais. É importante separar a inxestión porque o tempo para a súa asimilación é diferente. Os produtos cárnicos graxos deben descartarse, non se debe abusar da pataca, débese preferir os cereais cun contido medio en proteínas.
Non vaia a extremos e "sentarse" nunha dieta proteica. Non convén a todos, porque a exclusión completa dos hidratos de carbono levará a unha diminución da capacidade de traballo e da enerxía. É suficiente comer alimentos que conteñen hidratos de carbono pola mañá - isto dará enerxía durante o día, pola tarde, come comida con proteínas con poucas proteínas. Para compensar a falta de enerxía pola noite, o corpo comezará a queimar graxa corporal, con todo, este proceso será seguro para a saúde do corpo.
Asegúrese de incluír alimentos proteicos adecuados e preparados correctamente na súa dieta. Para o corpo, a proteína é o principal material de construción. Xunto co adestramento regular, axudarache a construír un fermoso corpo atlético.
As proteínas son os compostos químicos máis importantes, sen os cales a actividade vital do corpo sería imposible. As proteínas consisten en enzimas, células de órganos, tecidos. Son os responsables do metabolismo, o transporte e moitos outros procesos que teñen lugar no corpo humano. As proteínas non poden acumularse “en reserva”, polo tanto deben inxerirse regularmente. Son de especial importancia para as persoas involucradas no deporte, porque as proteínas están reguladas.
Niveis de organización

K. Lindstrom-Lang propuxo distinguir 4 niveis da organización estrutural das proteínas: estruturas primarias, secundarias, terciarias e cuaternarias. Aínda que esta división está algo anticuada, séguese utilizando. A estrutura primaria (secuencia de residuos de aminoácidos) dun polipéptido está determinada pola estrutura do seu xen e o seu código xenético, e estruturas de ordes superiores fórmanse durante o dobrado de proteínas. Aínda que a estrutura espacial da proteína no seu conxunto está determinada pola súa secuencia de aminoácidos, é bastante lábil e pode depender de condicións externas, polo tanto é máis correcto falar sobre a conformación proteica preferida ou máis enerxética.
Estrutura primaria

A estrutura primaria é a secuencia de residuos de aminoácidos na cadea polipeptídica. A estrutura primaria dunha proteína descríbese normalmente utilizando designacións dunha ou tres letras para residuos de aminoácidos.
As características importantes da estrutura primaria son motivos conservadores: combinacións estables de residuos de aminoácidos que realizan unha determinada función e que se atopan en moitas proteínas. Os motivos conservadores consérvanse durante a evolución das especies, a miúdo é posible predicir a función dunha proteína descoñecida. O grao de homoloxía (semellanza) das secuencias de aminoácidos das proteínas de distintos organismos pódese utilizar para avaliar a distancia evolutiva entre os taxons aos que pertencen estes organismos.
A estrutura primaria dunha proteína pode determinarse mediante métodos de secuenciación de proteínas ou pola estrutura primaria do seu ARNm usando a táboa de códigos xenéticos.
Estrutura secundaria
A estrutura secundaria é a ordenación local dun fragmento dunha cadea polipeptídica estabilizada por enlaces de hidróxeno.Os seguintes son os tipos máis comúns de estrutura proteica secundaria:
- As hélices α son xiros densos arredor do eixo longo da molécula. Unha vez son 3,6 residuos de aminoácidos, o paso de hélice é 0,54 nm (0,15 nm cae sobre un residuo de aminoácido) A espiral está estabilizada por enlaces de hidróxeno entre os grupos de péptidos H e O, separados entre 4 unidades. Aínda que a hélice α pode ser esquerda ou dereita, a dereita predomina nas proteínas. A espiral é perturbada polas interaccións electrostáticas do ácido glutámico, lisina, arginina. Un dos outros, as restos de asparagina, serina, treonina e leucina poden interferir estéricamente coa formación da hélice, os residuos prolinos provocan dobrado da cadea e tamén perturban as hélices α,
- As follas β (capas dobradas) son varias cadeas polipéptidas en zig-zag nas que se forman enlaces de hidróxeno entre aminoácidos relativamente distantes (0,34 nm por residuo de aminoácido) na estrutura primaria ou en diferentes cadeas proteicas (en lugar de espaciadas estreitamente, como é o caso. estar na hélice α). Estas cadeas normalmente están dirixidas polos extremos N en direccións opostas (orientación antiparalela) ou nunha dirección (estrutura β paralela). Tamén é posible a existencia dunha estrutura β mixta constituída por estruturas β paralelas e antiparalelas. Para a formación de follas β, son importantes pequenos tamaños dos grupos laterais de aminoácidos, normalmente predominan glicina e alanina,
- π-hélice
- 310espirais
- fragmentos sen orden.
Estrutura terciaria

A estrutura terciaria é a estrutura espacial da cadea polipeptídica. Estruturalmente, consta de elementos dunha estrutura secundaria estabilizada por varios tipos de interaccións nas que as interaccións hidrofóbicas xogan un papel crucial. A estabilización da estrutura terciaria implica:
- enlaces covalentes (entre os dous residuos de cisteína - pontes disulfuro),
- enlaces iónicos entre grupos laterais cargados opostamente de residuos de aminoácidos,
- enlaces de hidróxeno
- interaccións hidrofóbicas. Ao interactuar coas moléculas de auga que o rodean, a molécula de proteína está dobrada de xeito que os grupos laterais non polares de aminoácidos están illados da solución acuosa e aparecen grupos laterais hidrofílicos polares na superficie da molécula.
Estudos sobre os principios do pregamento de proteínas demostraron que é conveniente distinguir outro nivel entre o nivel da estrutura secundaria e a estrutura espacial atómica: o motivo do dobramento (arquitectura, motivo estrutural). O motivo do estilo vén determinado pola disposición mutua dos elementos de estrutura secundaria (α-helices e cadeas β) dentro do dominio proteico - un glóbulo compacto que pode existir por si só ou formar parte dunha proteína maior xunto con outros dominios. Considere, por exemplo, un dos motivos característicos da estrutura das proteínas. A proteína globular que aparece na figura da dereita, a triosofosfatisomerase, ten un motivo plegable chamado cilindro α / β: 8 cadeas β paralelas forman un cilindro β dentro doutro cilindro composto por 8 hélices α. Este motivo atópase en aproximadamente o 10% das proteínas.
Sábese que os motivos de estilo son bastante conservadores e atópanse en proteínas que non teñen relacións funcionais nin evolutivas. A determinación de motivos de estilo subxace na clasificación física ou racional de proteínas (como CATH ou SCOP).
Para determinar a estrutura espacial da proteína, úsanse métodos de análise de difracción de raios X, resonancia magnética nuclear e algúns tipos de microscopía.
Estrutura cuaternaria
A estrutura cuaternaria (ou subunidade, dominio) é a disposición mutua de varias cadeas polipéptidas nun complexo proteico único.As moléculas proteicas que compoñen a proteína coa estrutura cuaternaria fórmanse por separado nos ribosomas e só despois do final da síntese forman unha estrutura supramolecular común. Unha proteína cuaternaria pode conter cadeas polipéptidas idénticas e diferentes. A estabilización da estrutura cuaternaria implica os mesmos tipos de interaccións que na estabilización do Terciario. Os complexos proteicos supramoleculares poden consistir en decenas de moléculas.
Clasificación por tipo de edificio
As proteínas pódense dividir en tres grupos segundo o tipo xeral de estrutura:
- As proteínas fibrilares forman polímeros, a súa estrutura normalmente é moi regular e está apoiada principalmente por interaccións entre distintas cadeas. Forman microfilamentos, microtúbulos, fibrilas e apoian a estrutura de células e tecidos. As proteínas fibrilares inclúen queratina e coláxeno.
- As proteínas globulares son solubles en auga, a forma xeral da molécula é máis ou menos esférica.
- Proteínas da membrana: teñen dominios que se cruzan entre a membrana celular, pero partes delas sobresaen da membrana cara ao medio intercelular e o citoplasma celular. As proteínas de membrana actúan como receptores, é dicir, transmiten sinais e tamén proporcionan transporte transmembrana de varias substancias. Os transportadores de proteínas son específicos, cada un deles só pasa certas moléculas ou un certo tipo de sinal pola membrana.
Proteínas sinxelas e complexas
Ademais das cadeas péptidas, moitas proteínas tamén inclúen grupos non aminoácidos e, por este criterio, as proteínas divídense en dous grandes grupos: proteínas simples e complexas (proteidas). As proteínas simples só consisten en cadeas polipeptídicas, as proteínas complexas tamén conteñen grupos non aminoácidos ou protésicos. Dependendo da natureza química dos grupos protésicos, as seguintes clases distínguense entre proteínas complexas:
- As glicoproteínas que conteñen residuos de carbohidratos ligados covalentemente como grupo protésico, as glicoproteínas que conteñen residuos de mucopolisacáridos pertencen á subclase de proteoglicanos. Na formación dun enlace cos residuos de carbohidratos, normalmente interveñen grupos hidroxilo de serina ou treonina. A maioría das proteínas extracelulares, en particular as inmunoglobulinas, son as glicoproteínas. Nos proteoglicanos, a parte de carbohidratos é
O 95% da masa total da molécula de proteína, son o compoñente principal da matriz intercelular,
2. A significación biolóxica da reprodución de organismos. Métodos de reprodución.
1. A reprodución e o seu significado.
Reprodución: reprodución de organismos similares que proporciona
a existencia de especies durante moitos milenios contribúe a un aumento de
o número de individuos da especie, a continuidade da vida. Asexual, sexual e
propagación vexetativa de organismos.
2. A reprodución asexual é a forma máis antiga. En
un organismo está implicado na sexualidade, mentres que a maioría das veces participa en relacións sexuais
dous individuos. Nas plantas, reprodución asexual con esporas - unha
células especializadas. Propagación por esporas de algas, musgo, cola de cabalo,
saqueadores, fentos. Raza de esporas das plantas, xerminación e desenvolvemento de
os novos organismos subsidiarios en condicións favorables. Morte dun número enorme
disputa que entra en condicións adversas. Baixa probabilidade de ocorrencia
novos organismos procedentes de esporas porque conteñen poucos nutrientes e
a plántula as absorbe principalmente do ambiente.
3. Propagación vexetativa - propagación de plantas con
empregando órganos vexetativos: brotes aéreos ou subterráneos, partes da raíz,
folla, tubérculo, bulbos. Participación na propagación vexetativa dun organismo
ou partes delas. A afinidade da filla planta coa nai, como ela
continúa o desenvolvemento do corpo da nai. Gran eficiencia e
a propagación da propagación vexetativa na natureza, como organismo subsidiario
formado máis rápido da parte materna que da espora. Exemplos vexetativos
cría: utilizando rizomas - lirio do val, menta, pastos de trigo, etc., enraizamento
ramas inferiores tocando o chan (capas) - groselhas, uvas silvestres, bigote
- amorodos, bulbos - tulipán, narciso, azafrán. Uso de vexetativos
cría ao cultivar plantas cultivadas: as patacas son propagadas por tubérculos,
bulbos - cebola e allo, capas - groselhas e grosellas, raíz
descendencia - cereixa, ameixa, recortes - árbores froiteiras.
4. Reprodución sexual. A esencia da reprodución sexual
na formación de células xermes (gametos), a fusión da célula xerminante masculina
(esperma) e femia (ovo) - fertilización e desenvolvemento dun novo
un organismo filla dun ovo fecundado. Grazas á fertilización
un organismo subsidiario cun conxunto máis diverso de cromosomas, o que significa con máis
varios trazos hereditarios, froito dos cales pode resultar
máis adaptado ao hábitat. A presenza de reprodución sexual en
algas, musgos, helechos, ximnospermas e anxiospermas. Complicación
o proceso sexual nas plantas durante a súa evolución, a aparición das máis complexas
fórmase en plantas de semente.
5. A propagación das sementes prodúcese coa axuda de sementes,
é característico de ximnospermas e anxiospermas (anxiospermas
a propagación vexetativa tamén está xeneralizada). Secuencia de pasos
propagación de sementes: polinización - transferencia de pole ao estigma dun pistilo, o seu
xerminación, emerxencia dividindo dous espermatozoides, o seu progreso en
óvulo, a continuación, a fusión dun espermatozoide cun ovo, e do outro
núcleo secundario (en anxiospermas). Formación de semente de óvulo
o embrión cunha subministración de nutrientes e das paredes do ovario - o feto. Semente -
o xerme dunha nova planta, en condicións favorables, brota e por primeira vez
a plántula é alimentada polos nutrientes da semente, e logo polas súas raíces
comezar a absorber auga e minerais do chan, e as follas - dióxido de carbono
gas do aire na luz solar. A vida independente dunha nova planta.
Biofísica de proteínas
Propiedades físicas da proteína na célula, tendo en conta a membrana de auga e o aglomerado de macromoléculas (eng.) moi complicado. A hipótese dunha proteína como un "sistema cristalino" ordenado - un "cristal aperiodico" - está apoiada na análise de difracción de raios X (ata unha resolución de 1 angstrom), alta densidade de embalaxe, a cooperatividade do proceso de desnaturalización e outros feitos.
A favor doutra hipótese, as propiedades como o líquido das proteínas nos procesos de movementos intraglobulares (modelo de salto limitado ou difusión continua) evidencianse mediante experimentos de dispersión de neutróns, espectroscopia de Mössbauer.

Método universal: síntese ribosómica
As proteínas son sintetizadas por organismos vivos a partir de aminoácidos a partir da información codificada nos xenes. Cada proteína consiste nunha secuencia única de residuos de aminoácidos, que está determinada pola secuencia de nucleótidos do xene que codifica a proteína. O código xenético é un método para traducir a secuencia de nucleótidos do ADN (vía ARN) á secuencia de aminoácidos dunha cadea polipeptídica. Este código determina a correspondencia de seccións de trinucleótidos de ARN, chamados codóns, e certos aminoácidos que están incluídos na proteína: a secuencia de nucleótidos de AUG, por exemplo, corresponde á metionina. Dado que o ADN consta de catro tipos de nucleótidos, o número total de codóns posibles é 64 e, dado que se usan 20 aminoácidos en proteínas, moitos aminoácidos están determinados por máis dun codón. Tres codóns son insignificantes: serven como sinais de parada para a síntese da cadea polipeptídica e denomínanse codóns de terminación ou codóns de parada.
Os xenes que codifican as proteínas transcríbense por primeira vez na secuencia de nucleótidos do ARN mensaxeiro (ARNm) por encimas da ARN polimerase. Na gran maioría dos casos, as proteínas dos organismos vivos sintetízanse en ribosomas - máquinas moleculares multicomponentes presentes no citoplasma das células. O proceso de síntese dunha cadea polipeptídica por un ribosoma nunha matriz de ARNm chámase tradución.
A síntese de proteínas ribosómicas é fundamentalmente a mesma en procariotas e eucariotas, pero difire nalgúns detalles. Así, o ARNm procariota pode ser lido polos ribosomas na secuencia de aminoácidos das proteínas inmediatamente despois da transcrición ou incluso antes da súa finalización. Nas eucariotas, a transcrición primaria debe pasar primeiro por unha serie de modificacións e pasar ao citoplasma (á localización do ribosoma) antes de que poida comezar a tradución. A taxa de síntese de proteínas é maior en procariotas e pode chegar a 20 aminoácidos por segundo.

Incluso antes do comezo da tradución, as enzimas aminoacil-ARNt sintetasa unen específicamente aminoácidos ao seu correspondente ARN de transporte (ARNt). Unha rexión de ARNt, chamado anticodón, pode combinarse complementariamente cun codón ARNm, asegurando así a inclusión dun residuo de aminoácido unido ao ARNt na cadea polipeptídica de acordo co código xenético.
Durante a etapa inicial de tradución, iniciación, o codón iniciador (normalmente metionina) recoñécese pola pequena subunidade do ribosoma, ao que está unido o ARNt de metionina aminoacilado usando factores proteicos de inicio. Despois de recoñecer o codón inicial, a subunidade grande únese á pequena subunidade do ribosoma, e comeza a segunda etapa de tradución, a elongación. A cada paso do ribosoma do extremo 5'- ao 3'do ARNm, léase un codón formando enlaces de hidróxeno entre el e o ARN de transporte complementario a el, ao que está unido o correspondente residuo de aminoácido. A formación dun enlace péptido entre o último residuo de aminoácido do péptido en crecemento e o residuo de aminoácido unido ao ARNt é catalizado polo ARN ribosómico (ARNr), que forma o centro de peptidil transferase do ribosoma. Este centro sitúa os átomos de nitróxeno e carbono nunha posición favorable para o paso da reacción. A terceira e última etapa da tradución, a terminación, ocorre cando o ribosoma chega ao codón de parada, despois do cal os factores de terminación de proteínas hidrolizan a conexión entre o último ARNt e a cadea polipeptídica, detendo a súa síntese. Nos ribosomas, as proteínas sempre sintetízanse desde o terminal N- ata o C-terminal.
Síntese neribosómica
En fungos inferiores e algunhas bacterias, coñécese un método adicional (non ribosómico, ou multienzima) de biosíntese de péptidos, normalmente de estrutura pequena e pouco común.A síntese destes péptidos, normalmente metabolitos secundarios, é realizada por un complexo proteico de gran peso molecular, NRS sintase, sen a participación directa de ribosomas. A NRS sintase xeralmente está composta por varios dominios ou proteínas individuais que seleccionan aminoácidos, forman un enlace peptídico e liberan un péptido sintetizado. En conxunto, estes dominios conforman o módulo. Cada módulo asegura a inclusión dun aminoácido no péptido sintetizado. As sintases NRS poden estar compostas por un ou varios módulos. Ás veces, estes complexos inclúen un dominio capaz de isomerizar os aminoácidos L (forma normal) nunha forma D.
Síntese química
As proteínas curtas pódense sintetizar químicamente usando métodos de síntese orgánica, por exemplo, ligación química. Na maioría das veces, a síntese química do péptido prodúcese na dirección do extremo C ao extremo N, en oposición á biosíntese en ribosomas. O método de síntese química produce péptidos inmunoxénicos curtos (epítopos), que despois se inxectan aos animais co fin de obter anticorpos ou hibridomas específicos. Ademais, este método tamén se usa para obter inhibidores de certos encimas. A síntese química permite a introdución de residuos de aminoácidos que non se atopan nas proteínas convencionais, por exemplo, os que teñen etiquetas de fluorescencia unidas ás súas cadeas laterais. Os métodos químicos para a síntese de proteínas teñen varias limitacións: son ineficaces cunha lonxitude de proteína de máis de 300 residuos de aminoácidos, as proteínas sintetizadas artificialmente poden ter unha estrutura terciaria irregular e carecen de modificacións características post-translacionais (ver máis abaixo).
Modificación post-translacional

Despois de completar a tradución, a maioría das proteínas sofren outras modificacións químicas chamadas modificacións post-translacionais. Coñécense máis de duascentas variantes de modificacións postraducionais das proteínas.
As modificacións post-translacionais poden regular a vida útil das proteínas na célula, a súa actividade enzimática e as interaccións con outras proteínas. Nalgúns casos, as modificacións post-translacionais son unha etapa obrigatoria da maduración das proteínas, se non é funcionalmente inactiva. Por exemplo, coa maduración da insulina e algunhas outras hormonas, necesítase unha proteólise limitada da cadea polipeptídica, e coa maduración das proteínas da membrana plasmática é necesaria a glicosilación.
As modificacións post-translacionais poden ser estendidas e raras, ata exclusivas. Un exemplo dunha modificación universal é a ubiquitinación (unión dunha cadea de varias moléculas da curta proteína da ubiquitina a unha proteína), que serve como sinal para a ruptura desta proteína polo proteasoma. Outra modificación común é a glicosilación - estímase que aproximadamente a metade das proteínas humanas están glicosiladas. As modificacións raras inclúen a tirosinación / detirozinación e poliglicilación da tubulina.
Unha e a mesma proteína poden sufrir numerosas modificacións. Así, as histonas (proteínas que forman parte da cromatina nos eucariotas) en diferentes condicións poden sufrir máis de 150 modificacións diferentes.
As modificacións post-translacionais divídense en:
- principais modificacións do circuíto,
- escisión do residuo de metionina N-terminal,
- proteólise limitada: eliminación dun fragmento de proteína que pode ocorrer nos extremos (división de secuencias de sinal) ou, nalgúns casos, no medio da molécula (maduración da insulina),
- a unión de varios grupos químicos a grupos amino e carboxilo libres (N-acilación, miristoilación, etc.),
- modificacións das cadeas laterais de aminoácidos,
- a adición ou escisión de pequenos grupos químicos (glicosilación, fosforilación, etc.),
- a adición de lípidos e hidrocarburos,
- o cambio dos residuos de aminoácidos estándar ao estándar (a formación de citrulina),
- a formación de pontes disulfuro entre os residuos de cisteína,
- a adición de pequenas proteínas (sumoilación e ubicuitación).
Transporte e ordenación intracelulares
As proteínas sintetizadas no citoplasma dunha célula eucariota deben transportarse a distintos organoides celulares: o núcleo, as mitocondrias, o retículo endoplasmático (EPR), o aparato de Golgi, os lisosomas, etc., e algunhas proteínas deben entrar no medio extracelular. Para entrar nunha determinada sección da célula, a proteína debe ter unha etiqueta específica. Na maioría dos casos, tal etiqueta forma parte da secuencia de aminoácidos da propia proteína (péptido líder ou secuencia sinal da proteína), pero nalgúns casos, os oligosacáridos unidos á proteína son a etiqueta.
O transporte de proteínas no EPR realízase ao sintetizarse, xa que os ribosomas que sintetizan as proteínas cunha secuencia de sinal para que o EPR se "sitúe" en proteínas especiais na súa membrana exterior. Dende o EPR ao aparato Golgi, e de aí aos lisosomas e á membrana externa ou ao medio extracelular, as proteínas entran mediante transporte vesicular. As proteínas cun sinal de localización nuclear entran no núcleo a través dos poros nucleares. En mitocondrias e cloroplastos, as proteínas que posúen as secuencias sinal correspondentes entran a través de poros tradutores de proteínas específicos coa participación de chaperonas.
Mantemento da estrutura e degradación
O mantemento da correcta estrutura espacial das proteínas é crucial para o seu normal funcionamento. O dobre incorrecto das proteínas que leva á súa agregación pode ser causado por mutacións, oxidación, condicións de estrés ou cambios globais na fisioloxía da célula. A agregación de proteínas é un signo característico do envellecemento. Crese que o dobre de proteínas inadecuado é a causa ou a agravación de enfermidades como a fibrosis quística, a enfermidade de acumulación lisosómica. así como trastornos neurodegenerativos (Alzheimer, Huntington e Parkinson).
No proceso de evolución celular, desenvolvéronse catro mecanismos principais para contrarrestar a agregación de proteínas. Os dous primeiros - dobramento repetido (replegamento) coa axuda de chaperonas e escisión con proteases - atópanse tanto en bacterias como en organismos superiores. As eucariotas son características da autofagia e da acumulación de proteínas dobradas incorrectamente en orgánulos especiais sen membrana.

A capacidade das proteínas para restaurar a estrutura tridimensional correcta despois da desnaturalización permitiunos hipotetizar que toda a información sobre a estrutura final da proteína está contida na súa secuencia de aminoácidos. Actualmente, a teoría de que a conformación estable dunha proteína ten unha enerxía libre mínima é comparada con outras posibles conformacións deste polipéptido.
Nas células hai un grupo de proteínas cuxa función é garantir o correcto dobramento doutras proteínas despois da súa síntese no ribosoma, restaurar a estrutura das proteínas despois do seu dano, así como a creación e disociación dos complexos proteicos. Estas proteínas chámanse chaperonas. A concentración de moitas chaperonas na célula aumenta cun forte aumento da temperatura ambiente, polo que pertencen ao grupo Hsp (proteínas de calor de inglés en inglés - proteínas de choque de calor). A importancia do funcionamento normal das chaperonas para o funcionamento do corpo pódese ilustrar co exemplo da chaperona α-cristalina, que forma parte da lente do ollo humano. As mutacións desta proteína conducen ao ensombrecemento da lente debido á agregación de proteínas e, como resultado, a cataratas.
Se a estrutura terciaria das proteínas non se pode restaurar, son destruídas pola célula. As enzimas que degradan as proteínas chámanse proteases.No lugar de ataque da molécula de substrato, as encimas proteolíticas divídense en endopeptidases e exopeptidases:
- As endopeptidases, ou proteases, fenden enlaces péptidos dentro da cadea peptídica. Recoñecen e unen secuencias peptídicas curtas de substratos e relativamente específicamente hidrolizan os enlaces entre certos residuos de aminoácidos.
- As exopeptidases hidrolizan péptidos dos extremos da cadea: aminopeptidases do terminal N, carboxipeptidasas do terminal C. Finalmente, as dipeptidases fenden só dipeptidos.
Segundo o mecanismo de catálise, a Unión Internacional para a Bioquímica e a Bioloxía Molecular identifica varias clases de proteases, incluídas as proteasas serinas, as proteases asparticas, as cisteinas proteasas e as metaloproteasas.
Un tipo especial de protease é o proteasoma, unha gran proteasa multisubunitaria presente no núcleo e no citoplasma de eucariotas, arqueas e algunhas bacterias.
Para que a proteasoma sexa escindida pola proteína diana, debe etiquetarse achegándoa unha pequena proteína ubiquitina. A reacción de adición da ubiquitina é catalizada polas encimas ubiquitinas ligases. A adición da primeira molécula de ubiquitina á proteína serve como sinal para ligases para a adición adicional de moléculas de ubiquitina. Como resultado, unha cadea de poliubiquitina está unida á proteína, que se une ao proteasoma e asegura a división da proteína diana. En xeral, este sistema chámase degradación de proteínas dependente da ubiquitina. A degradación do 80-90% das proteínas intracelulares prodúcese coa participación do proteasoma.
A degradación das proteínas nos peroxisomas é importante para moitos procesos celulares, incluído o ciclo celular, a regulación da expresión xénica e a resposta ao estrés oxidativo.

A autofagia é o proceso de degradación das biomoléculas de longa duración, en particular as proteínas, así como dos orgánulos nos lisosomas (nos mamíferos) ou dos vacúolos (nos lévedos). A autofagia acompaña a actividade vital de calquera célula normal, pero a falta de nutrientes, a presenza de orgánulos danados no citoplasma e, finalmente, a presenza de proteínas parcialmente desnaturalizadas e os seus agregados no citoplasma poden servir de estímulos para potenciar os procesos de autofagia nas células.
Distínguense tres tipos de autofagia: microautofagia, macroautofagia e autofagia dependente de chaperona.
Durante a microautofagia, o lisosoma é capturado por macromoléculas e fragmentos de membranas celulares. Deste xeito, a célula pode dixerir proteínas con falta de enerxía ou material de construción (por exemplo, durante a fame). Pero os procesos de microautofagia ocorren en condicións normais e normalmente son indiscriminados. Ás veces tamén se dixeren organoides durante a microautofagia, por exemplo, a microautofagia de peroxisomas e a microautofagia parcial de núcleos nos que a célula permanece viable descríbese na levadura.
En macroautofagia, unha parte do citoplasma (que adoita conter calquera organoides) está rodeada por un compartimento de membrana similar a unha cisterna do retículo endoplasmático. Como resultado, este sitio está separado do resto do citoplasma por dúas membranas. Estes orgánulos de dobre membrana denomínanse autofagosomas. Os autofagosomas fusionan cos lisosomas, formando autofagolisosomas, nos que se dixeren os orgánulos e o resto dos contidos dos autofagosomas. Ao parecer, a macroautofagia tamén non é selectiva, aínda que a miúdo resalta que coa axuda dela a célula pode desfacerse de organoides que teñen "anticuados" (mitocondrias, ribosomas, etc.).
O terceiro tipo de autofagia depende de chaperona. Neste método prodúcese un transporte dirixido de proteínas parcialmente desnaturalizadas dende o citoplasma a través da membrana lisosoma ata a súa cavidade, onde son dixeridas. Este tipo de autofagia, descrita só en mamíferos, é inducida polo estrés.

JUNQ e IPOD
Baixo o estrés, cando unha célula eucariota non pode facer fronte á acumulación dun gran número de proteínas desnaturalizadas, pode enviarse a un dos tipos de orgánulos temporais: JUNQ e IPOD (inglés) ruso. .
JUNQ (compartimento de control da calidade nuclear JUxta) está asociado ao lado externo da membrana nuclear e contén proteínas ubiquitinadas que se poden transferir rapidamente ao citoplasma, así como chaperonas e proteasomas. A función pretendida por JUNQ é refoldear e / ou degradar as proteínas.
O IPOD (inglés Insoluble Protein deposit - un lugar de deposición de proteínas insolubles) está situado preto do vacúolo central e contén agregados inmóbiles de proteínas formadoras de amiloide. A acumulación destas proteínas no IPOD pode evitar a súa interacción con estruturas móbiles normais, polo tanto, crese que esta inclusión ten unha función protectora.
As funcións das proteínas no corpo
Como outras macromoléculas biolóxicas (polisacáridos, lípidos e ácidos nucleicos), as proteínas son compoñentes esenciais de todos os organismos vivos e xogan un papel importante na vida da célula. As proteínas realizan procesos metabólicos. Forman parte de estruturas intracelulares - orgánulos e citoesqueleto, secretados no espazo extracelular, onde poden actuar como sinal transmitido entre células, participar na hidrólise dos alimentos e na formación de sustancia intercelular.
A clasificación das proteínas segundo as súas funcións é bastante arbitraria, xa que a mesma proteína pode desempeñar varias funcións. Un exemplo ben estudado de tal multifuncionalidade é a lisil-ARNt sintetasa, unha enzima da clase de aminoacil ARNt sintetas, que non só une o residuo de lisina ao ARNt, senón que tamén regula a transcrición de varios xenes. As proteínas realizan moitas funcións debido á súa actividade enzimática. Entón, as enzimas son a proteína motora da miosina, as proteínas reguladoras da proteína quinase, o transporte da proteína adenosina trifosfatase, sodio-potasio, etc.

Función catalítica
A función máis coñecida das proteínas no corpo é a catálise de varias reaccións químicas. As enzimas son proteínas que teñen propiedades catalíticas específicas, é dicir, cada enzima cataliza unha ou máis reaccións similares. As enzimas catalizan a división de moléculas complexas (catabolismo) e a súa síntese (anabolismo), incluída a replicación e reparación do ADN e a síntese de ARN matricial. Para 2013, describíronse máis de 5.000 enzimas. A aceleración da reacción como resultado da catálise enzimática pode ser enorme: a reacción catalizada pola encima orotidina-5'-fosfato descarboxilase, por exemplo, procede 10 17 veces máis rápido que a non catalizada (a vida media da descarboxilación do ácido orótico é de 78 millóns de anos sen que a enzima conteña 18 milisegundos). As moléculas que se unen ao encima e cambian como resultado da reacción chámanse substratos.
Aínda que as enzimas normalmente consisten en centos de residuos de aminoácidos, só unha pequena fracción deles interacciona co substrato, e cantidades aínda máis pequenas - de media 3-4 residuos de aminoácidos, a miúdo situados lonxe os uns dos outros na estrutura primaria - están directamente implicados na catálise. A parte da molécula de encima que proporciona a unión do substrato e a catálise chámase centro activo.
En 1992, a Unión Internacional de Bioquímica e Bioloxía Molecular propuxo a versión final da nomenclatura xerárquica de enzimas en función do tipo de reaccións catalizadas por estas. Segundo esta nomenclatura, os nomes das enzimas deben ter sempre un final -o básico e fórmanse a partir dos nomes das reaccións catalizadas e dos seus substratos. A cada encima atribúeselle un código individual polo cal é fácil determinar a súa posición na xerarquía dos encimas.Segundo o tipo de reaccións catalizadas, todas as enzimas divídense en 6 clases:
- CF 1: oxidoreductases que catalizan reaccións redox,
- CF 2: transferencias que catalizan a transferencia de grupos químicos dunha molécula de substrato a outra,
- CF 3: Hidrólases que catalizan a hidrólise de enlaces químicos,
- CF 4: Liases que catalizan a rotura de enlaces químicos sen hidrólise coa formación dun dobre enlace nun dos produtos,
- CF 5: Isomerases que catalizan cambios estruturais ou xeométricos na molécula de substrato,
- CF 6: Ligases que catalizan a formación de enlaces químicos entre substratos debido á hidrólise do enlace ATP difosfato ou un trifosfato similar.
Función estrutural
As proteínas estruturais do citoesqueleto, como unha especie de armadura, dan forma ás células e a moitos organoides e están implicadas no cambio da forma das células. A maioría das proteínas estruturais son filamentosas: os monómeros de actina e tubulina son, por exemplo, proteínas globulares e solubles, pero despois da polimerización forman longas cordas que compoñen o citoesqueleto, o que permite á célula manter a forma. O coláxeno e a elastina son os compoñentes principais da substancia intercelular do tecido conectivo (por exemplo, cartilaxe), e o pelo, as uñas, as plumas de aves e algunhas cunchas están formadas por outra proteína estrutural de queratina.

Función protectora
Existen varios tipos de funcións protectoras das proteínas:
- Protección física. A protección física do corpo é proporcionada polo coláxeno, unha proteína que forma a base da substancia intercelular dos tecidos conectivos (incluíndo ósos, cartilaxe, tendóns e capas profundas da pel (derme)), a queratina, que forma a base de escudos cornosos, cabelos, plumas, cornos e outros derivados da epiderme. Normalmente, estas proteínas considéranse proteínas con función estrutural. Exemplos de proteínas deste grupo son o fibrinóxeno e a trombina implicados na coagulación do sangue.
- Protección química. A unión de toxinas ás moléculas proteicas pode proporcionar a súa desintoxicación. Un papel particularmente importante na desintoxicación en humanos xogan as encimas hepáticas que descompoñen os venenos ou os converten nunha forma soluble, o que contribúe á súa rápida eliminación do corpo.
- Defensa inmune. As proteínas que compoñen sangue e outros líquidos corporais están implicadas na resposta defensiva do corpo tanto ao dano como ao ataque de patóxenos. As proteínas do sistema do complemento e os anticorpos (inmunoglobulinas) pertencen ás proteínas do segundo grupo, neutralizan bacterias, virus ou proteínas estranxeiras. Os anticorpos que forman parte do sistema inmune adaptativo, únense a substancias alleas ao corpo, aos antíxenos e, polo tanto, neutralízanas, dirixíndoas aos lugares de destrución. Os anticorpos pódense secretar no espazo intercelular ou fixarse nas membranas dos linfocitos B especializados chamados plasmocitos.
Función reguladora
Moitos procesos no interior das células están regulados por moléculas de proteína, que non son unha fonte de enerxía nin un material de construción para a célula. Estas proteínas regulan o avance das células no ciclo celular, transcrición, tradución, empalme, actividade doutras proteínas e moitos outros procesos. As proteínas realizan a función reguladora ou ben debido á actividade enzimática (por exemplo, proteínas quinases) ou debido á unión específica a outras moléculas. Así, os factores de transcrición, as proteínas activadoras e as proteínas represoras, poden regular a intensidade de transcrición dos xenes uníndose ás súas secuencias reguladoras. A nivel de tradución, a lectura de moitos ARNm tamén está regulada pola adición de factores proteicos.
O papel máis importante na regulación dos procesos intracelulares xogan as proteínas quinases e as proteínas fosfatases - enzimas que activan ou inhiben a actividade doutras proteínas uníndose a elas ou dividindo grupos fosfatos.

Función de sinal
A función de sinal das proteínas é a capacidade das proteínas para servir como substancias sinalizadoras, transmitindo sinais entre células, tecidos, órganos e organismos. Moitas veces, a función de sinal combínase coa reguladora, xa que moitas proteínas reguladoras intracelulares tamén transmiten sinais.
A función de sinalización realízase por proteínas hormonais, citocinas, factores de crecemento, etc.
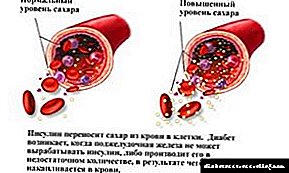
As hormonas son transportadas polo sangue. A maioría das hormonas animais son proteínas ou péptidos. A unión da hormona ao seu receptor é un sinal que desencadea unha resposta celular. As hormonas regulan a concentración de substancias no sangue e células, o crecemento, a reprodución e outros procesos. Un exemplo de tales proteínas é a insulina, que regula a concentración de glicosa no sangue.
As células interactúan entre si empregando proteínas sinalizadoras transmitidas a través da sustancia intercelular. Estas proteínas inclúen, por exemplo, citocinas e factores de crecemento.
As citocinas son moléculas de sinalización péptida. Regulan as interaccións entre células, determinan a súa supervivencia, estimulan ou inhiben o crecemento, a diferenciación, a actividade funcional e a apoptose, aseguran a coordinación dos sistemas inmune, endocrino e nervioso. Un exemplo de citocinas é o factor de necrose tumoral, que transmite sinais inflamatorias entre as células do corpo.
Función de reposto (de espera)
Estas proteínas inclúen as chamadas proteínas de reserva, que se almacenan como fonte de enerxía e sustancia nas sementes das plantas (por exemplo, globulinas 7S e 11S) e ovos de animais. Outras proteínas úsanse no corpo como fonte de aminoácidos, que á súa vez son precursores de substancias bioloxicamente activas que regulan os procesos metabólicos.

Función do receptor
Os receptores de proteínas poden localizarse tanto no citoplasma como integrarse na membrana celular. Unha parte da molécula receptora recibe un sinal, que é máis frecuentemente servido por unha sustancia química, e nalgúns casos - estrés leve, mecánico (por exemplo, estiramento) e outros estímulos. Cando un sinal está exposto a unha parte específica da molécula -a proteína do receptor- prodúcense cambios conformacionais. Como resultado, a conformación doutra parte da molécula, que transmite un sinal a outros compoñentes celulares, cambia. Existen varios mecanismos de transmisión de sinal. Algúns receptores catalizan unha determinada reacción química, outros serven como canles iónicos, que se abren ou pechan á acción dun sinal, mentres que outros ligan específicamente a moléculas mediadoras intracelulares. Nos receptores de membrana, a parte da molécula que se une á molécula sinal está na superficie da célula e o dominio que transmite o sinal está dentro.
Función motor (motor)
Toda unha clase de proteínas motoras proporciona movementos corporais, por exemplo, a contracción muscular, incluída a locomoción (miosina), o movemento de células dentro do corpo (por exemplo, o movemento ameboide de leucocitos), o movemento de cilios e flagelos, así como o transporte intracelular activo e dirixido (kinesina, dyneína) . As diineínas e as kinesinas transportan moléculas ao longo dos microtúbulos usando a hidrólise ATP como fonte de enerxía. As dineínas transfiren moléculas e orgánulos das partes periféricas da célula cara ao centrosoma, kinesinas - no sentido oposto. As dineínas tamén son responsables do movemento de cilios e flaxelos de eucariotas. As variantes citoplasmáticas de miosina poden estar implicadas no transporte de moléculas e organoides a través de microfilamentos.
Proteínas no metabolismo
A maioría dos microorganismos e plantas poden sintetizar 20 aminoácidos estándar, así como aminoácidos adicionais (non estándar), como a citrulina.Pero se os aminoácidos están no ambiente, incluso os microorganismos conserven enerxía ao transportar aminoácidos ás células e desactivar as súas vías biosintéticas.
Os aminoácidos que os animais non poden sintetizar son chamados esenciais. Os animais principais en vías biosintéticas, por exemplo, aspartato quinase, que cataliza o primeiro paso na formación de lisina, metionina e treonina a partir de aspartato, están ausentes en animais.
Os animais obteñen principalmente aminoácidos das proteínas que se atopan nos alimentos. As proteínas son destruídas durante a dixestión, que normalmente comeza coa desnaturalización da proteína colocándoa nun ambiente ácido e hidrolizándoa usando enzimas chamadas proteasas. Algúns aminoácidos obtidos como resultado da dixestión úsanse para a síntese de proteínas do corpo, mentres que o resto convértese en glicosa durante a gluconeoxénese ou úsanse no ciclo de Krebs. O uso de proteínas como fonte de enerxía é especialmente importante nas condicións de xaxún, cando as propias proteínas do corpo, especialmente os músculos, serven de fonte de enerxía. Os aminoácidos tamén son unha importante fonte de nitróxeno na nutrición do corpo.
Non hai normas unificadas para a inxestión de proteínas humanas. A microflora do intestino groso sintetiza aminoácidos que non se teñen en conta na preparación das normas proteicas.
Métodos de estudo
A estrutura e as funcións das proteínas están estudadas tanto en preparados purificados in vitroe no seu medio natural nun organismo vivo, in vivo. Os estudos de proteínas puras en condicións controladas son útiles para determinar as súas funcións: características cinéticas da actividade catalítica de encimas, afinidade relativa para diversos substratos, etc. Estudos de proteínas in vivo en células ou organismos enteiros proporcionan información adicional sobre onde funcionan e como se regula a súa actividade.
Bioloxía molecular e celular

Os métodos de bioloxía molecular e celular úsanse comunmente para estudar a síntese e localización de proteínas nunha célula. Un método de estudo da localización é amplamente utilizado, baseado na síntese dunha proteína quimérica nunha célula, consistente na proteína estudada, conectada a un "reporteiro", por exemplo, unha proteína fluorescente verde (GFP). A localización de tal proteína na célula pódese ver usando un microscopio fluorescente. Ademais, as proteínas pódense visualizar usando anticorpos que as recoñecen, que á súa vez levan unha etiqueta fluorescente. A miúdo, ao mesmo tempo que a proteína estudada, preséntanse a miúdo proteínas de tales orgánulos como o retículo endoplasmático, o aparato Golgi, os lisosomas e os vacúolos, o que permite determinar máis exactamente a localización da proteína estudada.
Os métodos inmunohistoquímicos adoitan empregar anticorpos conxugados con enzimas que catalizan a formación dun produto luminiscente ou coloreado, o que permite comparar a localización e cantidade de proteínas estudadas nas mostras. Unha técnica máis rara para determinar a localización das proteínas é a ultracentrifugación de equilibrio das fraccións celulares nun gradiente de sacarosa ou cloruro de cesio.
Finalmente, un dos métodos clásicos é a microscopía inmunoelectrónica, fundamentalmente similar á microscopía de inmunofluorescencia coa diferenza de que se usa un microscopio electrónico. A mostra prepárase para a microscopía electrónica e logo procesada con anticorpos a unha proteína que está conectada a un material denso en electróns, normalmente ouro.
Usando mutagénese dirixida ao sitio, os investigadores poden cambiar a secuencia de aminoácidos dunha proteína e, en consecuencia, a súa estrutura espacial, a ubicación na célula e a regulación da súa actividade. Usando este método, empregando ARNt modificados, tamén se poden introducir aminoácidos artificiais nunha proteína e pódense construír proteínas con novas propiedades.
Bioquímicos
Para realizar unha análise in vitro a proteína debe purificarse doutros compoñentes celulares. Este proceso normalmente comeza coa destrución de células e a obtención do chamado extracto celular. Ademais, mediante métodos de centrifugación e ultracentrifugación, este extracto pódese dividir en: unha fracción que contén proteínas solubles, unha fracción que contén lípidos e proteínas de membrana e unha fracción que contén orgánulos celulares e ácidos nucleicos.

A precipitación das proteínas por salgada úsase para separar as mesturas de proteínas e tamén permite a concentración de proteínas. A análise de sedimentación (centrifugación) permite fraccionar as mesturas de proteínas polo valor da constante de sedimentación de proteínas individuais, medida en svedbergs (S). A continuación, úsanse varios tipos de cromatografía para illar a proteína ou proteínas desexadas en función de propiedades como peso molecular, carga e afinidade. Ademais, as proteínas poden illarse segundo a súa carga empregando electrofocus.
Para simplificar o proceso de purificación de proteínas, úsase a miúdo a enxeñaría xenética, o que permite crear derivados de proteínas convenientes para a purificación sen afectar a súa estrutura ou actividade. "Etiquetas", que son pequenas secuencias de aminoácidos, por exemplo, unha cadea de 6 ou máis residuos de histidina, e están unidas a un extremo da proteína. Cando o extracto das células que sintetizan a proteína "marcada" pasa a través dunha columna cromatográfica que contén ións níquel, a histidina únese con níquel e permanece na columna, mentres que os restantes compoñentes do lisato pasan pola columna sen restricións (cromatografía de níquel-quelato). Moitas outras etiquetas deseñáronse para axudar aos investigadores a illar proteínas específicas de mesturas complexas, a maioría das veces empregando cromatografía de afinidade.
O grao de purificación de proteínas pódese determinar se se coñece o seu peso molecular e o seu punto izoeléctrico - usando varios tipos de electroforese en xel - ou medindo a actividade enzimática se a proteína é un encima. A espectrometría de masas permite identificar a proteína seleccionada polo seu peso molecular e a masa dos seus fragmentos.
Proteómica
A totalidade das proteínas celulares chámase proteoma, o seu estudo - proteómica, chamado por analoxía coa xenómica. Os principais métodos de proteómica experimental inclúen:
- Electroforese 2D, que permite a separación de mesturas de proteínas multicomponentes,
- espectrometría de masas, que permite a identificación de proteínas pola masa dos seus péptidos constituíntes con alto rendemento,
- microarrays proteicas, que permiten medir simultaneamente o contido dun gran número de proteínas na célula,
- sistema de levadura de dous híbridos , o que permite estudar sistematicamente as interaccións proteína-proteína.
A totalidade de todas as interaccións biológicamente significativas de proteínas nunha célula chámase interactoma. Un estudo sistemático da estrutura das proteínas que representan todos os posibles tipos de estruturas terciarias denomínase xenómica estrutural.
Predición e modelaxe da estrutura
Predición da estrutura espacial mediante programas informáticos (en silico) permite construír modelos proteicos cuxa estrutura aínda non se determinou experimentalmente. O tipo de predición estrutural máis exitoso, coñecido como modelado homolóxico, depende da estrutura "template" existente, similar en secuencia de aminoácidos á proteína simulada. Os métodos para predecir a estrutura espacial das proteínas úsanse no campo en desenvolvemento da enxeñaría xenética de proteínas, coa axuda da cal xa se obtiveron novas estruturas terciarias de proteínas. Unha tarefa computacional máis complexa é a predición de interaccións intermoleculares, como o atracamento molecular e a predición de interaccións proteína-proteína.
O pliegue e as interaccións intermoleculares de proteínas pódense modelar mediante mecánica molecular. , en particular, a dinámica molecular e o método Monte Carlo, que cada vez están a aproveitar a computación paralela e distribuída (por exemplo, o proxecto Folding @ home).O pliegue de pequenos dominios proteicos α-helicoidal, como a proteína do villano ou unha das proteínas do VIH, modeláronse con éxito en silico. Usando métodos híbridos combinando dinámicas moleculares estándar con mecánica cuántica, investigáronse os estados electrónicos do pigmento visual da rodopsina.