Apidra: instrucións oficiais de uso
A forma de dosificación de Apidra é unha solución para a administración subcutánea (sc): un líquido transparente case incoloro ou incoloro (10 ml en botellas, 1 botella nunha caixa de cartón, 3 ml en cartuchos, nun paquete de ampolla: 5 cartuchos para unha pluma de xiringa. "OptiPen" ou 5 cartuchos montados nunha pluma de xeringa desechable "OptiSet" ou 5 sistemas de cartuchos "OptiClick").
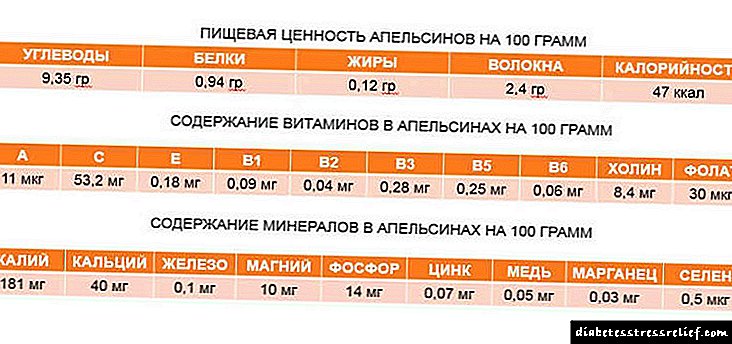
En 1 ml de solución contén:
- substancia activa: insulina glulisina - 3,49 mg (equivalente a 100 UI de insulina humana),
- compoñentes auxiliares: trometamol, m-cresol, polisorbato 20, cloruro de sodio, ácido clorhídrico concentrado, hidróxido de sodio, auga para a inxección.
Contraindicacións
- hipoglucemia,
- idade dos nenos ata 6 anos (a información clínica sobre o uso é limitada),
- hipersensibilidade á insulina glulisina ou a calquera outro compoñente do medicamento.
Con precaución, Apidra recoméndase para o seu uso durante o embarazo.
Os pacientes con insuficiencia hepática poden requirir unha dose menor de insulina debido a unha diminución da gluconeoxénese e unha desaceleración do metabolismo da insulina.
Tamén é posible reducir a necesidade de insulina coa insuficiencia renal e na vellez (debido á deterioración da función renal).
Dosificación e administración
A insulina Apidra adminístrase inmediatamente antes dunha comida (durante 0-15 minutos) ou inmediatamente despois dunha comida por inxección de s.c. ou infusión continua na graxa subcutánea mediante un sistema de acción bomba.
A dose e o modo de administración do medicamento selecciónanse individualmente.
A solución Apidra úsase en réximes de terapia complexa con insulina de acción media ou con análogo de insulina / insulina de acción longa; está permitido o uso combinado con medicamentos hipoglicémicos orais.
Áreas corporais recomendadas para a administración de medicamentos:
- inxección s / c: producida no ombreiro, coxa ou abdome, mentres que a introdución na parede abdominal dá unha absorción lixeiramente máis rápida,
- infusión continua: realizada na graxa subcutánea no abdome.
Debe alternar os lugares de infusión e inxección con cada administración posterior do medicamento.
Dado que a forma de dosificación de Apidra é unha solución, non se necesita resuspensión antes de usala.
A taxa de absorción e, en consecuencia, o inicio e a duración do medicamento poden variar baixo a influencia da actividade física, segundo o lugar de inxección da solución e outros factores cambiantes.
Hai que ter coidado ao administrar o medicamento para excluír a posibilidade de que este entre directamente nos vasos sanguíneos. Despois do procedemento, a área de inxección non debe masaxe.
Aos pacientes hai que ensinarlle técnicas de inxección.
Cando se administra o medicamento usando un sistema de bomba para infusión de insulina, a solución non se pode mesturar con ningunha outra sustancia / axente medicinal.
A solución Apidra non se mestura con ningún outro medicamento, agás a isofan-insulina humana. Neste caso, Apidra está introducido primeiro na xeringa e a inxección realízase inmediatamente despois da mestura. Non se dispón de datos sobre o uso de solucións mesturadas moito antes da inxección.
Os cartuchos deben usarse co bolígrafo de insulina OptiPen Pro1 ou outros dispositivos similares de acordo coas instrucións do fabricante para cargar o cartucho, achegar a agulla e inxectar insulina. Antes de usar o cartucho, debes realizar unha comprobación visual do medicamento. Para a inxección, só é adecuada unha solución incolora clara e que non conteña inclusións sólidas visibles. Antes da instalación, o cartucho debe manterse primeiro durante 1-2 horas a temperatura ambiente e, antes de introducir a solución, hai que eliminar as burbullas de aire do cartucho.
Non se poden volver cargar cartuchos usados. Non se pode usar o bolígrafo OptiPen Pro1 danado.
En caso de un mal funcionamento da xeringa, a solución pódese extraer do cartucho nunha xeringa de plástico adecuada para a insulina a unha concentración de 100 UI / ml, e logo administrada ao paciente.
Unha pluma de xeringa reutilizable só se usa por inxección a un paciente (para evitar a infección).
Todas as recomendacións e regras anteriores tamén deben seguirse ao usar a solución Apidra do sistema de cartuchos e a pluma xeringa OptiClick, que son un cartucho de vidro cun mecanismo de pistón unido, fixado nun recipiente de plástico transparente e que contén 3 ml de solución de insulina glulisina.
Efectos secundarios
O efecto secundario indesexable máis común da insulinoterapia é a hipoglucemia, que normalmente ocorre cando se usa insulina en doses significativamente superiores ás requiridas.
Reaccións adversas adversas asociadas á administración do fármaco por órganos e sistemas de pacientes rexistrados durante ensaios clínicos (a lista ofrécese mediante a seguinte gradación de frecuencia de aparición: máis do 10% - moi a miúdo, máis do 1%, pero menos do 10% - a miúdo, máis 0,1%, pero menos do 1% - ás veces, máis do 0,01%, pero menos do 0,1% - raramente, menos do 0,01% - moi raramente):
- metabolismo: moi a miúdo - hipoglucemia, acompañada dos seguintes síntomas de súpeto: suor fría, palidez da pel, fatiga, ansiedade, tremor, axitación nerviosa, debilidade, confusión, somnolencia, dificultade para concentrarse, trastornos visuais, náuseas, fame excesiva, dor de cabeza, palpitacións graves, as consecuencias dun aumento da hipoglucemia poden ser: perda de consciencia e / ou convulsións, deterioración temporal ou permanente da función cerebral, en casos extremos, desenlace fatal
- pel e tecidos subcutáneos: a miúdo - manifestacións alérxicas, como inchazo, hiperemia, picazón no lugar da inxección, normalmente continuando por conta propia con terapia continuada, rara vez lipodistrofia, debido principalmente a unha violación da alternancia de lugares de inxección de insulina en calquera das áreas / readministración do fármaco. ao mesmo lugar
- Reaccións de hipersensibilidade: ás veces - asfixia, aperte no peito, urticaria, picazón, dermatite alérxica, en casos graves de reaccións alérxicas xeneralizadas (incluída anafiláctica), é posible a vida.
Non hai datos específicos sobre os síntomas da sobredose de insulina da glulisina, pero debido ao uso prolongado de altas doses de Apidra, son posibles distintos graos de severidade da hipoglucemia.
A terapia da afección depende do grao da enfermidade:
- episodios de hipoglucemia leve - parando co uso de glicosa ou produtos que conteñen azucre, en relación aos que se recomenda aos pacientes con diabetes ter sempre galletas, doces, anacos de azucre refinado, zume de froitas doces,
- episodios de hipoglucemia grave (con perda de coñecemento) - deterse intramuscularmente (intramuscularmente) ou sc mediante a administración de 0,5-1 mg de glucagón, ou administración iv (intravenosa) de glicosa (dextrosa) a falta de resposta á administración de glucagón a durante 10-15 minutos Despois de recuperar a conciencia, aconséllase que o paciente administre hidratos de carbono cara ao interior para evitar un ataque reiterado de hipoglucemia, despois do cal, para establecer a causa da hipoglucemia grave, e tamén para evitar o desenvolvemento de tales episodios do paciente, é necesario observar durante algún tempo no hospital.
Instrucións especiais
No caso de transferir o paciente á insulina doutro fabricante ou dun novo tipo de insulina, é necesaria unha supervisión médica estrita, xa que pode ser necesaria a corrección da terapia no seu conxunto.
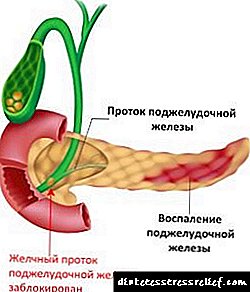
As doses inadecuadas de insulina ou a terminación pouco razoable da terapia, especialmente en pacientes con diabetes tipo 1, poden causar hiperglicemia e cetoacidosis diabética - condicións potencialmente mortais. O tempo do probable desenvolvemento da hipoglucemia depende directamente da velocidade de acción da insulina usada e pode, polo tanto, cambiar coa corrección do réxime de tratamento.
As principais condicións que poden cambiar ou facer menos pronunciados os síntomas do hipoglucemia:
- presenza prolongada de diabetes no paciente,
- neuropatía diabética
- intensificación da insulinoterapia,
- o uso simultáneo de certas drogas, por exemplo, bloqueadores β,
- conversión a insulina humana de insulina de orixe animal.
A corrección das doses de insulina tamén pode ser necesaria no caso de cambiar un réxime de actividade motora ou nutrición. O aumento da actividade física obtida inmediatamente despois da comida pode aumentar a probabilidade de desenvolver hipoglucemia. En comparación coa acción da insulina humana soluble, a hipoglucemia pode desenvolverse máis pronto despois da administración de análogos de insulina de acción rápida.
As reaccións hipoclicémicas ou hiperglicémicas non compensadas poden producir perda de consciencia, coma ou morte.
As enfermidades concomitantes ou as sobrecargas emocionais tamén poden alterar a necesidade de insulina do paciente.
Interacción farmacolóxica
Non se realizaron estudos sobre a interacción farmacocinética de Apidra, pero en base a datos dispoñibles para medicamentos similares, pódese concluír que é improbable que unha interacción farmacocinética clínicamente significativa.
Algúns fármacos / drogas poden afectar o metabolismo da glicosa, o que pode requirir o axuste das doses de insulina glulisina e un control máis cercano da terapia e do estado do paciente.
Entón, cando se usa xunto coa solución Apidra:
- fármacos hipoglicémicos orais, inhibidores da enzima que converten a angiotensina, disopiramidas, fluoxetina, fibratos, inhibidores da monoamina oxidasa, propoxifeno, pentoxifilina, antimicrobianos de sulfonamida, salicilatos - poden aumentar o efecto hipoglicémico da insulina e aumentar a hipoglucemia,
- glucocorticosteroides, diuréticos, danazol, diazoxido, isoniazido, somatropina, derivados da fenotiazina, simpatomiméticos (epinefrina / adrenalina, terbutalina, salbutamol), estróxenos, hormonas tiroideas, progestinas (anticonceptivos orais), antipsicotina, antipsicotina, antipsicotina, antipsicotina capaz de reducir o efecto hipoglucémico da insulina,
- clonidina, bloqueadores β, etanol, sales de litio - potencian ou debilitan o efecto hipoglucémico da insulina,
- pentamidina: pode provocar hipoglucemia, seguida de hiperglicemia,
- fármacos con actividade simpatolítica (β-bloqueantes, guanetidina, clonidina, reserpina) - con hipoglucemia poden reducir a gravidade ou enmascarar os síntomas da activación adrenérxica reflexa.
Non se realizaron estudos sobre a compatibilidade da insulina glulisina, polo tanto, Apidra non debe mesturarse con ningún outro medicamento, a excepción é a isofan-insulina humana.
No caso da introdución da solución usando unha bomba de infusión, Apidra non debe mesturarse con outras drogas.
Os análogos de Apidra son: Vozulim-R, Actrapid (NM, MS), Gensulin R, Biosulin R, Insuman Rapid GT, Insulin MK, Insulin-Fereyn CR, Gansulin R, Humalog, Pensulin (SR, CR), Monosuinsulin (MK, MP ), Humulin Regular, NovoRapid (Penfill, FlexPen), Humodar R, Monoinsulina CR, Insuran R, Rinsulin R, Rosinsulin R.
Termos e condicións de almacenamento
Almacenar no seu propio envase de cartón, sen acceso á luz, a unha temperatura de 2-8 ºC. Non conxele. Mantéñase fóra do alcance dos nenos!
Despois de abrir o paquete, garde nun lugar protexido da luz a temperaturas de ata 25 ºC. A vida útil do medicamento despois do seu primeiro uso é de 4 semanas (recoméndase marcar na etiqueta a data da primeira inxestión da solución).
Propiedades farmacolóxicas
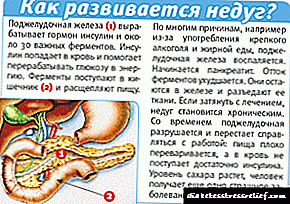
A acción máis importante dos análogos de insulina e insulina, incluída a insulina glulisina, é a regulación do metabolismo da glicosa. A insulina reduce a concentración de glicosa no sangue, estimulando a absorción de glicosa por tecidos periféricos, especialmente os músculos esqueléticos e o tecido adiposo, ademais de inhibir a formación de glicosa no fígado. A insulina suprime a lipólise nos adipocitos, inhibe a proteólise e aumenta a síntese de proteínas. Estudos realizados en voluntarios sans e pacientes con diabetes mellorable demostraron que coa administración de sc a insulina a glulisina comeza a actuar máis rápido e ten unha duración de acción menor que a insulina humana soluble. Con administración subcutánea, baixando a concentración de glicosa no sangue, a acción da insulina glulisina comeza en 10-20 minutos. Cando se administra por vía intravenosa, o efecto hipoglucémico da insulina glulisina e da insulina humana soluble son iguais en forza. Unha unidade de insulina glulisina ten a mesma actividade de redución de glicosa que unha unidade de insulina humana soluble.
Nun estudo de fase I en pacientes con diabetes tipo 1, os perfís de redución da glicosa da insulina glulisina e da insulina humana soluble administráronse subcutaneamente a unha dose de 0,15 U / kg en diferentes momentos en relación a unha comida estándar de 15 minutos. Os resultados do estudo demostraron que a insulina glulisina administrada 2 minutos antes dunha comida proporcionou o mesmo control glicémico despois dunha comida como a insulina humana soluble administrada 30 minutos antes da comida. Cando se administrou 2 minutos antes da comida, a insulina glulisina proporcionou un mellor control glicémico despois dunha comida que a insulina humana soluble administrada 2 minutos antes da comida. A insulina en glulisina administrada 15 minutos despois do inicio da comida deu o mesmo control glicémico despois da comida que a insulina humana soluble, administrada 2 minutos antes da comida.
Un estudo de fase I con insulina glulisina, insulina lispro e insulina humana soluble nun grupo de pacientes obesos demostrou que nestes pacientes a insulina glulisina conserva as súas características de acción rápida. Neste estudo, o tempo para alcanzar o 20% do AUC total foi de 114 minutos para a insulina glulisina, 121 min para a insulina lispro e 150 min para a insulina humana soluble, e AUQ(0-2 h)Tamén reflectiron a actividade de redución da glicosa precoz, respectivamente, de 427 mg / kg para a insulina glulisina, 354 mg / kg para a insulina lispro e de 197 mg / kg para a insulina humana soluble.
Estudos clínicos
Diabetes tipo 1.
Nun ensayo clínico de 26 semanas da fase III, no que se comparou a insulina glulisina coa insulina lispro, administrada subcutaneamente pouco antes das comidas (0-15 minutos), para pacientes con diabetes mellitus tipo 1 que usaban insulina glargina como insulina basal, a insulina glulisina era comparable con insulina lispro para o control glicémico, que se valorou polo cambio na concentración de hemoglobina glicada (HbA1s) no momento do punto final do estudo en comparación co valor inicial. Cando se administrou insulina, a glulisina, a diferenza do tratamento con insulina lispro, non requiriu un aumento da dose de insulina basal.
Un estudo clínico en fase III de 12 semanas en pacientes con diabetes tipo 1 que recibiron insulina glargina como terapia basal demostrou que a eficacia da administración de insulina glulisina inmediatamente despois da comida era comparable á da insulina glulisina inmediatamente antes das comidas (para 0 -15 min) ou insulina humana soluble (30-45 min antes das comidas).
No grupo de pacientes que recibiron insulina glulisina antes das comidas, observouse unha diminución significativamente maior do HbA1s en comparación cun grupo de pacientes que reciben insulina humana soluble.
Diabetes tipo 2
Realizouse un ensaio clínico en fase III de 26 semanas seguido por un seguimento de 26 semanas en forma de estudo de seguridade para comparar a insulina glulisina (0-15 minutos antes das comidas) coa insulina humana soluble (30-45 minutos antes das comidas), que se inxectaron subcutáneamente en pacientes con diabetes mellitus tipo 2, ademais de usar insulina isófana como insulina basal. A glulisina insulina demostrou ser comparable á insulina humana soluble con respecto aos cambios nas concentracións de HbA1s despois de 6 meses e despois de 12 meses de tratamento en comparación co valor inicial.
Durante infusión continua de insulina mediante un dispositivo tipo bomba (para diabetes mellitus tipo 1), en 59 pacientes tratados con Apidra ® ou insulina aspart nos dous grupos de tratamento, observouse unha baixa incidencia de oclusión de catéter (0,08 oclusións por mes ao usar o fármaco. Apidra ® e 0,15 oclusións ao mes ao usar insulin aspart), así como unha frecuencia similar ás reaccións no lugar da inxección (10,3% ao usar Apidra ® e 13,3% ao usar insulina aspart).
En nenos e adolescentes con diabetes mellitus tipo 1, que recibían insulina base unha vez ao día pola noite, insulina glargina, ou dúas veces ao día pola mañá e á noite, insulina isófana, ao comparar a eficacia e a seguridade do tratamento con insulina glulisina e insulina lispro coa súa para a administración 15 minutos antes da comida, demostrouse que o control glicémico, a incidencia de hipoglucemia, que requiría a intervención de terceiros, así como a incidencia de episodios hipoglucemios graves eran comparables en ambos os grupos de tratamento. Ademais, despois de 26 semanas de tratamento, os pacientes que recibiron tratamento con insulina con glulisina para conseguir un control glicémico comparable á insulina lispro requiriron un aumento significativamente menor das doses diarias de insulina basal, insulina de acción rápida e a dose total de insulina.
Raza e xénero
Nos ensaios clínicos controlados en adultos, as diferenzas na seguridade e eficacia da insulina glulisina non se amosaron na análise de subgrupos distinguidos por raza e xénero.
Farmacocinética
Na insulina, a glulisina, a substitución do aminoácido asparagina da insulina humana na posición B3 coa lisina e a lisina na posición B29 polo ácido glutámico favorece unha absorción máis rápida.
Absorción e biodisponibilidade
As curvas farmacocinéticas de concentración-tempo en voluntarios sans e pacientes con diabetes mellitus tipo 1 e tipo 2 demostraron que a absorción de insulina da glulisina en comparación coa insulina humana soluble foi aproximadamente 2 veces máis rápida e a concentración máxima de plasma alcanzada (Cmax) foi de aproximadamente 2. veces máis.
Nun estudo realizado en pacientes con diabetes mellitus tipo 1, despois da administración de sc de insulina glulisina a unha dose de 0,15 U / kg, Tmáx (tempo de inicio da concentración plasmática máxima) foi de 55 minutos e Cmáx foi de 82 ± 1,3 μU / ml en comparación con Tmáxconstituíndo 82 minutos e Cmáxde 46 ± 1,3 mcU / ml para insulina humana soluble. O tempo medio de residencia na circulación sistémica para a insulina glulisina foi menor (98 minutos) que para a insulina humana soluble (161 minutos).
Nun estudo realizado en pacientes con diabetes mellitus tipo 2 despois da administración de insulina glulisina a unha dose de 0,2 pezas / kg Cmáx foi de 91 μED / ml cunha latitud interquartil de 78 a 104 μED / ml.
Cando se administrou s / c de insulina, glulisina na rexión da parede abdominal anterior, da coxa ou do ombreiro (na rexión do músculo deltoide), a absorción foi máis rápida cando se introduciu na rexión da parede abdominal anterior en comparación coa administración do fármaco na rexión da coxa. A taxa de absorción da rexión deltoide foi intermedia. A biodisponibilidade absoluta de insulina glulisina despois da administración de sc foi de aproximadamente o 70% (o 73% da parede abdominal anterior, o 71 do músculo deltoide e o 68% da cadeira) e presentou unha baixa variabilidade en diferentes pacientes.
Distribución e retirada
A distribución e excreción da insulina glulisina e da insulina humana soluble despois da administración intravenosa son similares, con volumes de distribución de 13 litros e 21 litros e semivida de 13 e 17 minutos, respectivamente. Tras a administración da insulina, a glulisina é excretada máis rápido que a insulina humana soluble, tendo unha vida media aparente de 42 minutos, en comparación coa aparente semivida de insulina humana soluble de 86 minutos. Nunha análise transversal dos estudos de insulina glulisina, tanto en individuos sans como en diabete tipo 1 e tipo 2, a vida media aparente da eliminación oscilou entre os 37 e os 75 minutos.
Farmacocinámicos en grupos especiais de pacientes
Pacientes con insuficiencia renal
Nun estudo clínico realizado en pacientes sen diabetes cun amplo rango de estado funcional dos riles (limpieza de creatinina (CC)> 80 ml / min, 30-50 ml / min, ® en mulleres embarazadas. Unha cantidade limitada de datos obtidos sobre o uso de insulina glulizina en mulleres embarazadas (informáronse menos de 300 resultados no embarazo), non indica o seu efecto adverso sobre o embarazo, o desenvolvemento fetal ou un bebé acabado de nacer. Os estudos reprodutivos en animais non revelaron ningún lichy entre a insulina glulisina e de insulina humana en relación co embarazo, desenvolvemento embrionario / fetal, parto e desenvolvemento posnatal.
O uso de Apidra ® en mulleres embarazadas require precaución. É necesario un coidadoso control da concentración de glicosa no sangue e manter un control glicémico adecuado.
Os pacientes con diabetes pre-embarazo ou gestacional deben ter un control glicémico adecuado antes da concepción e durante todo o embarazo. Durante o primeiro trimestre do embarazo, a necesidade de insulina pode diminuír e, durante o segundo e terceiro trimestre, normalmente pode aumentar. Inmediatamente despois do nacemento, a demanda de insulina diminúe rapidamente.
Os pacientes con diabetes deben informar ao seu médico se están embarazadas ou planean quedar embarazadas.
Período de lactación
Non se sabe se a insulina glulisina pasa ao leite materno, pero, en xeral, a insulina non pasa ao leite materno e non se absorbe por administración oral.
En mulleres durante a lactación, pode ser necesaria unha corrección do réxime de dosificación de insulina e da dieta.
Dosificación e administración
Apidra ® debe usarse en réximes de tratamento que inclúen insulina de acción media, ou insulina de acción longa, ou un análogo de insulina de acción longa. Ademais, Apidra ® pode usarse en combinación con fármacos hipoglicémicos orais (PHGP).
O réxime de dosificación de Apidra ® está seleccionado individualmente segundo as recomendacións do médico de acordo coas necesidades do paciente. Recoméndase a todos os pacientes con diabetes que controlen a concentración de glicosa no sangue.
Uso en grupos especiais de pacientes
Nenos e adolescentes
Apidra ® pódese usar en nenos maiores de 6 anos e adolescentes. A información clínica sobre o uso da droga en nenos menores de 6 anos é limitada.
Pacientes anciáns
Os datos de farmacocinética dispoñibles en pacientes anciáns con diabetes mellitus son insuficientes.
A deterioración da función renal na vellez pode levar a unha diminución dos requirimentos de insulina.
Pacientes con insuficiencia renal
A necesidade de insulina na insuficiencia renal pode diminuír.
Pacientes con insuficiencia hepática
En pacientes con alteración da función hepática, a necesidade de insulina pode diminuír debido a unha capacidade reducida de gluconeoxénese e unha desaceleración do metabolismo da insulina.
Composición e forma de lanzamento
| Solución subcutánea | 1 ml |
| insulina glulisina | 3,49 mg |
| (corresponde a 100 UI de insulina humana) | |
| excipientes: m-cresol, trometamol, cloruro de sodio, polisorbato 20, hidróxido de sodio, ácido clorhídrico concentrado, auga para inxección |
en botellas de 10 ml ou en cartuchos de 3 ml, nun paquete de cartón 1 botella ou en empaquetado en tira blister 5 cartuchos para pluma ou xeringuilla OptiPen ou cartuchos montados nunha xiringa desbotable OptiSet ou co sistema OptiClick. .
Farmacodinámica
A insulina glulisina é un análogo recombinante da insulina humana, que é igual a forza da insulina humana común. A insulina glulisina comeza a actuar máis rápido e ten unha duración de acción menor que a insulina humana soluble. A acción máis importante dos análogos de insulina e insulina, incluída a insulina glulisina, é a regulación do metabolismo da glicosa. A insulina reduce a concentración de glicosa no sangue, estimulando a absorción de glicosa por tecidos periféricos, especialmente os músculos esqueléticos e o tecido adiposo, ademais de inhibir a formación de glicosa no fígado. A insulina inhibe a lipólise e proteólise do adipocito e aumenta a síntese de proteínas. Estudos realizados en voluntarios sans e pacientes con diabetes mellorable demostraron que coa administración de sc a insulina a glulisina comeza a actuar máis rápido e ten unha duración de acción menor que a insulina humana soluble. Cando se introduce a redución de glicosa no sangue, a acción da insulina glulisina comeza en 10-20 minutos. Coa administración de iv, os efectos de reducir os niveis de glicosa en sangue da insulina glulisina e da insulina humana soluble son iguais en forza. Unha unidade de insulina glulisina ten a mesma actividade de redución de glicosa que unha unidade de insulina humana soluble.
Nun estudo de fase I en pacientes con diabetes mellitus tipo 1, avaliáronse perfís de redución da glicosa da insulina glulisina e insulina humana soluble, administrados s.c. a unha dose de 0,15 unidades / kg en diferentes momentos respecto a unha comida estándar de 15 minutos.
Os resultados do estudo demostraron que a insulina glulisina, administrada 2 minutos antes dunha comida, proporcionou o mesmo control glicémico despois dunha comida que a insulina humana soluble, administrada 30 minutos antes da comida. Cando se administrou 2 minutos antes da comida, a insulina glulisina proporcionou un mellor control glicémico despois dunha comida que a insulina humana soluble administrada 2 minutos antes da comida. A insulina en glulisina, administrada 15 minutos despois do inicio da comida, deu o mesmo control glicémico despois das comidas que a insulina humana soluble, administrada 2 minutos antes da comida.
Obesidade Un estudo de fase I realizado con insulina glulisina, insulina lyspro e insulina humana soluble nun grupo de pacientes obesos demostrou que nestes pacientes a insulina glulisina conserva as súas características de acción rápida. Neste estudo, o tempo para alcanzar o 20% do AUC total foi de 114 minutos para a insulina glulisina, 121 minutos para a insulina lispro e 150 minutos para a insulina humana soluble e AUC (0-2 horas), que tamén reflicte a actividade de redución da glicosa precoz, foi de 427 mg · kg -1 - para insulina glulisina, 354 mg · kg -1 - para insulina lispro e 197 mg · kg -1 - para insulina humana soluble, respectivamente.
Diabetes tipo 1. Nun ensayo clínico de 26 semanas da fase III, no que se comparou a insulina glulisina coa insulina lispro, administrada s.c pouco antes das comidas (0-15 minutos), pacientes con diabetes mellitus tipo 1, que usaban insulina glargina, insulina glulisina como insulina basal Foi comparable á insulina lispro con respecto ao control glicémico, que foi valorado polo cambio na concentración de hemoglobina glicosilada (HbA)1C) no momento do estudo final en comparación co resultado. Observáronse valores comparables de glicosa no sangue, determinados por autocontrol. Pola administración da insulina glulisina, en contraste co tratamento con insulina, lyspro non requiriu un aumento da dose de insulina basal.
Un ensaio clínico en fase III de 12 semanas realizado en pacientes con diabetes tipo 1 que recibiron insulina glargina como terapia basal demostrou que a eficacia da administración de insulina glulisina inmediatamente despois das comidas era comparable á da insulina glulisina inmediatamente antes das comidas (para 0 –15 min) ou insulina humana soluble (30 a 45 minutos antes das comidas).
Na poboación de pacientes que completou o protocolo de estudo, no grupo de pacientes que recibiron insulina glulisina antes das comidas, observouse unha diminución significativamente maior do HbA.1C en comparación cun grupo de pacientes que reciben insulina humana soluble.
Diabetes tipo 2. Realizouse un ensaio clínico de 26 semanas de fase III seguido dun seguimento de 26 semanas en forma de estudo de seguridade para comparar a insulina glulisina (0-15 minutos antes das comidas) coa insulina humana soluble (30-45 minutos antes das comidas) que foron administrados sc en pacientes con diabetes mellitus tipo 2, ademais de usar insulina-isófano como basal. O índice medio de masa corporal do paciente foi de 34,55 kg / m2. A glulisina insulina demostrou ser comparable á insulina humana soluble con respecto aos cambios nas concentracións de HbA.1C despois de 6 meses de tratamento en comparación co resultado (-0,46% para a insulina glulisina e -0,30% para a insulina humana soluble, p = 0,0029) e despois de 12 meses de tratamento en comparación co resultado (-0,23% - para a insulina glulisina e -0,13% para a insulina humana soluble, a diferenza non é significativa). Neste estudo, a maioría dos pacientes (79%) mesturou a súa insulina de acción curta con insulina-isófano inmediatamente antes da inxección. No momento da aleatorización, 58 pacientes usaron medicamentos hipoglicémicos por vía oral e recibiron instrucións para continuar utilizándoos na mesma dose.
Orixe racial e xénero. Nos ensaios clínicos controlados en adultos, as diferenzas na seguridade e eficacia da insulina glulisina non se amosaron na análise de subgrupos identificados por raza e xénero.
Farmacocinética
Na insulina glulisina, a substitución do aminoácido asparagina da insulina humana na posición B3 coa lisina e a lisina na posición B29 polo ácido glutámico favorece unha absorción máis rápida.
Absorción e biodisponibilidade. As curvas farmacocinéticas de concentración-tempo en voluntarios sans e pacientes con diabetes mellitus tipo 1 e 2 demostraron que a absorción de insulina glulisina en comparación coa insulina humana soluble foi aproximadamente 2 veces máis rápida, alcanzando ata dúas veces maior Cmáx .
Nun estudo realizado en pacientes con diabetes mellitus tipo 1, despois da administración de sc de insulina glulisina a unha dose de 0,15 u / kg Tmáx (hora de ocorrencia Cmáx ) foi de 55 min e Cmáx en plasma foi de (82 ± 1,3) μed / ml en comparación con Tmáx constituíndo 82 min e Cmáx compoñente (46 ± 1,3) μed / ml, para insulina humana soluble. O tempo medio de residencia na circulación sistémica para a insulina glulisina foi menor (98 min) que para a insulina humana común (161 min).
Nun estudo en pacientes con diabetes mellitus tipo 2 despois da administración de insulina glulisina a unha dose de 0,2 u / kg Cmáx foi de 91 μed / ml cunha latitud interquartil de 78 a 104 μed / ml.
Coa administración subcutánea de insulina glulisina na parede abdominal anterior, coxa ou ombreiro (rexión do músculo deltoide), a absorción foi máis rápida cando se introduciu na parede abdominal anterior en comparación coa administración do medicamento na coxa. A taxa de absorción da rexión deltoide foi intermedia. A biodisponibilidade absoluta de insulina glulisina (70%) en diferentes sitios de inxección foi similar e presentou unha baixa variabilidade entre diferentes pacientes. Coeficiente de variación (CV) - 11%.
Distribución e retirada. A distribución e excreción da insulina glulisina e da insulina humana soluble despois da administración de iv son similares, con volumes de distribución de 13 e 22 L, e T1/2 constituíndo 13 e 18 min, respectivamente.
Despois da administración da insulina, a glulisina é excretada máis rápido que a insulina humana soluble, tendo unha aparente T1/2 42 minutos en comparación co T aparente1/2 insulina humana soluble, con 86 min. Nunha análise transversal dos estudos de insulina glulisina, tanto en individuos sans como en diabéticos tipo 1 e tipo 2, a aparente T1/2 os 37 e os 75 minutos.
Grupos especiais de pacientes
Insuficiencia renal. Nun estudo clínico realizado en individuos sen diabetes cun amplo rango de estado funcional dos riles (Cl creatinina> 80 ml / min, 30-50 ml / min, Tmáx e Cmáx semellantes ás dos adultos. Como nos adultos, cando se administra inmediatamente antes da proba de alimentos, a insulina glulisina proporciona un mellor control da glicosa no sangue despois das comidas que a insulina humana soluble. O aumento da concentración de glicosa no sangue despois da comida (0–6 h de AUC - a área baixo a curva para a concentración de glicosa no sangue - tempo de 0 a 6 h) foi de 641 mg · h · dl -1 - para a insulina glulisina e 801 mg · h · dl -1 - para insulina humana soluble.
Embarazo e lactación
Embarazo Non se dispón de información suficiente sobre o uso de insulina glulisina en mulleres embarazadas.
Os estudos reprodutivos en animais non revelaron diferenzas entre a insulina glulisina e a insulina humana con respecto ao embarazo, desenvolvemento fetal / fetal, parto e desenvolvemento postnatal.
Ao prescribir o medicamento ás mulleres embarazadas, deberase ter coidado. É necesario un control minucioso dos niveis de glicosa no sangue.
Os pacientes con diabetes pre-embarazo ou gestacional precisan manter un control metabólico óptimo durante todo o embarazo. Durante o primeiro trimestre do embarazo, a necesidade de insulina pode diminuír e, durante o segundo e terceiro trimestre, normalmente pode aumentar. Inmediatamente despois do nacemento, a demanda de insulina diminúe rapidamente.
Lactación Non se sabe se a insulina glulisina pasa ao leite materno, pero en xeral a insulina non penetra no leite materno e non é absorbida pola inxestión.
As nais lactantes poden necesitar un axuste de dose de insulina e dieta.
Sobredose
Síntomas Con exceso de dose de insulina en relación coa necesidade da mesma, que é determinada pola inxestión de alimentos e polo consumo de enerxía, pode producirse unha hipoglucemia.
Non hai datos específicos sobre unha sobredose de insulina glulisina. Non obstante, coa súa sobredose, a hipoglucemia pode desenvolverse de forma leve ou grave.
Tratamento: pódense deter os episodios de hipoglucemia leve con alimentos que conteñen glicosa ou azucre. Por iso, recoméndase que os pacientes con diabetes leven sempre anacos de azucre, doces, galletas ou zume de froitas doces.
Os episodios de hipoglucemia grave, durante os que o paciente perde a consciencia, poden ser parados mediante administración intramuscular ou sc de 0,5-1 mg de glucagón, que é realizada pola persoa que recibiu as instrucións adecuadas, ou administración iv de dextrosa (glicosa) por parte dun profesional médico. Se o paciente non responde á administración de glucagón durante 10-15 minutos, tamén é necesario administrar dextrosa iv.
Despois de recuperar a conciencia, recoméndase que o paciente se administre hidratos de carbono cara ao interior para evitar a recorrencia da hipoglucemia.
Despois da administración de glucagón, o paciente debe ser observado nun hospital para establecer a causa desta hipoglucemia grave e evitar o desenvolvemento doutros episodios similares.
Impacto na capacidade de conducir vehículos e mecanismos
Debe ter en conta que os pacientes teñan coidado e eviten desenvolver hipoglucemia mentres conducen vehículos ou maquinaria. Isto é especialmente importante en pacientes que teñen unha capacidade reducida ou ausente de recoñecer síntomas que indican o desenvolvemento de hipoglucemia ou que teñen episodios frecuentes de hipoglucemia. En tales pacientes, a cuestión sobre a posibilidade de conducilos con vehículos ou outros mecanismos debe decidir individualmente.
Instrucións de uso e manexo
Viales
Os frascos Apidra ® están deseñados para o uso con xeringas de insulina coa escala unitaria adecuada e para o seu uso co sistema de bombas de insulina.
Inspeccione a botella antes do uso. Só debe usarse se a solución é clara, incolora e non contén partículas visibles.
Infusión continua de sc utilizando un sistema de bomba.
Apidra ® pode utilizarse para infusión continua de insulina (NPII) mediante un sistema de bombas adecuado para a infusión de insulina con catéteres e depósitos adecuados.
O conxunto de infusión e depósito deben ser substituídos cada 48 horas cumprindo as regras asépticas.
Os pacientes que reciben Apidra ® a través dun NPI deberían ter insulina alternativa no stock en caso de fallo no sistema de bomba.
Cartuchos
Os cartuchos deben usarse xunto coa pluma de insulina AllStar e de acordo coas recomendacións das Instrucións de uso do fabricante deste dispositivo. Non se deben empregar con outras plumas de xeringa recargables, xa que a precisión da dosificación só se estableceu con esta pluma de xiringa.
As instrucións do fabricante para usar a xeringa pluma AllStar sobre a carga do cartucho, a fixación da agulla e a inxección de insulina deben ser seguidas exactamente. Inspeccione o cartucho antes do uso. Debe usarse só se a solución é clara, incolora, non contendo partículas sólidas visibles. Antes de introducir o cartucho na xeringa recargable, o cartucho debe estar a temperatura ambiente durante 1-2 horas. Antes da inxección, deberán eliminar as burbullas de aire do cartucho (ver instrucións de uso da xeringa). As instrucións de uso da pluma xeringa deben ser estritas. Non se poden volver cargar cartuchos baleiros. Se a pluma de xeringa "OlStar" (AllStar) está danada, non se pode usar.
Se a pluma non funciona correctamente, a solución pódese extraer do cartucho nunha xeringa de plástico adecuada á insulina a unha concentración de 100 PECES / ml e administrada ao paciente.
Para previr a infección, a pluma reutilizable debe usarse só no mesmo paciente.