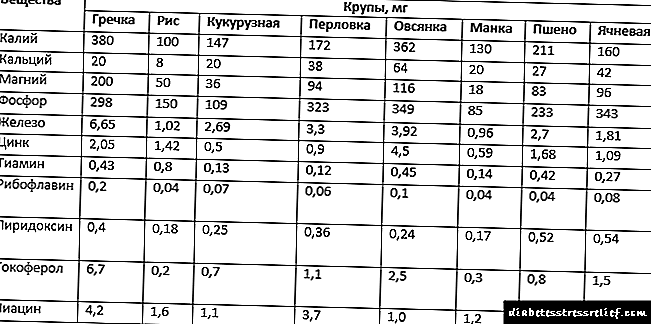
Regulación da síntese de colesterol
A regulación da síntese de colesterol - a súa encima clave (HMG-CoA reductasa) realízase de diferentes xeitos.
Fosforilación / desfosforilación de HMG reductasa. Cun aumento da relación insulina / glucagón, esta enzima se fosforila e pasa a estado activo. A acción da insulina realízase a través de 2 encimas.
A fosfase da HMG-CoA reductasa quinasa, o que converte a quinasa nun estado desfosforilado inactivo:
Fosfotase HMG-CoA reductasa converténdoa nun estado activo desfosforilado. O resultado destas reaccións é a formación dunha forma activa desfosforilada de HMG-CoA reductasa.
En consecuencia, durante o período de absorción, o colesterol aumenta. Durante este período, a dispoñibilidade do substrato inicial para a síntese de colesterol - acetil - CoA aumenta (como resultado de comer alimentos que conteñen hidratos e graxas, xa que o acetilo CoA fórmase durante a descomposición de glicosa e ácidos graxos).
No estado posabsorbente, o glucagón a través da proteingenase A estimula a fosforilación da HMG - CoA - reductasa, converténdoa nun estado inactivo. Esta acción vese reforzada polo feito de que o glucagón estimula ao mesmo tempo a fosforilación e a inactivación da fosfase da HMG-CoA reductasa, mantendo así a HMG-CoA reductasa nun estado fosforilado. Como resultado, a síntese de colesterol no período de posabsorción e durante o xaxún é inhibida por síntese endóxena. Se o contido de colesterol nos alimentos foi levado ao 2%, entón a síntese de colesterol endóxeno diminuíu drasticamente. Pero a cesación completa da síntese de colesterol non se produce.
O grao de inhibición da biosíntese do colesterol baixo a influencia do colesterol procedente dos alimentos varía de persoa a persoa. Isto indica a individualidade dos procesos de formación do colesterol. Ao reducir a intensidade da síntese de colesterol, é posible reducir a súa concentración no sangue.
Se o equilibrio entre a inxestión de colesterol con alimentos e a súa síntese no corpo por un lado e a excreción de ácidos biliares e colesterol por outro, a concentración de colesterol nos tecidos e o sangue cambia. As consecuencias máis graves están asociadas a un aumento da concentración de colesterol no sangue (hipercolesterolemia), mentres que a probabilidade de contraer aterosclerose e colelitiasis aumenta.
A hipercolesterolemia familiar (HCS) - esta forma é moito máis común - aproximadamente 1 paciente por cada 200 persoas. Un defecto herdado do HCS é unha violación da absorción de LDL por células e, polo tanto, unha diminución da taxa de catabolismo LDL. Como resultado, a concentración de LDL no sangue aumenta, así como o colesterol xa que hai moita cantidade na LDL. Polo tanto, co HCS, é característica a deposición de colesterol nos tecidos, en particular na pel (xanthomas), nas paredes das arterias.
Inhibición da síntese de HMG-CoA reductasa
O produto final da vía metabólica do colesterol. Reduce a taxa de transcrición do xene HMG-CoA reductasa, inhibindo así a súa propia síntese. O fígado está sintetizando activamente ácidos biliares a partir do colesterol e, polo tanto, os ácidos biliares inhiben a actividade do xen HMG-CoA reductasa. Dado que a HMG-CoA reductasa existe despois da síntese de aproximadamente 3, a inhibición da síntese deste encima do colesterol é unha regulación eficaz.
Non atopaches o que buscabas? Usa a busca:
Intercambio de ésteres de colesterol
O fondo de colesterol contén coléter gratis e ésteres de colesterol, que se atopan tanto nas células como nas lipoproteínas do sangue.
Parte II. Metabolismo e enerxía
Nas células, a esterificación do colesterol prodúcese coa acción da acil-CoA-colesterol-aciltransferase (AChAT):
Acilo-CoA + Colesterol - * HS-KoA + Aciclolesterol
Nas células humanas fórmase principalmente linoleilcolesterol. A diferenza do colesterol libre, os seus ésteres nas membranas celulares están contidos en cantidades moi pequenas e atópanse principalmente no citosol como parte das pingas de lípidos. A formación de ésteres pode considerarse, por un lado, como un mecanismo para eliminar o exceso de colesterol das membranas e, por outra banda, como un mecanismo para o almacenamento do colesterol na célula. A mobilización de recursos prodúcese coa participación de encimas esterase que hidrolizan os ésteres de colesterol:
Aciclolesterol + H 2O - * Ácido graxo + Colesterol
A síntese e hidrólise de ésteres ocorre en moitas células, pero é especialmente activa en células da córtex suprarrenal: nestas células ata o 80% de todo o colesterol está representado por ésteres, mentres que noutras células normalmente é inferior ao 20%.
A formación de ésteres en liponroteínas sanguíneas prodúcese coa participación da lecitina-colesterol aciltransferase (LHAT), que cataliza a transferencia do residuo acilo da posición i da lecitina ao colesterol (fig. 10.31). A LHAT fórmase no fígado, secretada no sangue e unida ás lipoproteínas. A taxa de esterificación de diferentes lipoproteínas é significativamente diferente e depende da presenza de apolipoproteínas que activan LHAT (principalmente apo-AT, así como CI) ou inhiben (C-II) este encima.O LHAT máis activo en HDL, no que apo-AT ten que olee 2/3 de todas as proteínas. As maiores distincións coli ésteres de ácidos oleico e linoleico formados. As outras lipoproteínas de estériles formación ocorre a un ritmo máis lento do que en HDL.
Fig. 10.31. A formación de ésteres de colesterol baixo a acción do LHAT
O LHAT está localizado na capa superficial do HDL e usa o colesterol na monocapa fosfolípida como substrato. Os ésteres de colesterol formados aquí, debido á súa completa hidrofobicidade, están mal conservados
Tema 10. Metabolismo e función lipídica
monocapa fosfolípida e inmersa no núcleo lipídico da lipoproteína. Ao mesmo tempo, libérase un lugar para o colesterol na monocapa fosfolípida, que se pode encher con colesterol das membranas celulares ou doutras lipoproteínas. Así, o HDL parece ser unha trampa de colesterol como resultado da acción do LHAT.
Síntese de ácido biliar
No fígado, parte do colesterol convértese en ácidos biliares. Os ácidos galos poden considerarse como derivados do ácido colánico (Fig. 10.32).
O ácido colanico como tal non está formado no corpo. Nos hepatocitos, o colesterol produce directamente ácidos chenodeoxicólicos e chólicos - ácidos biliares primarios (Fig. 10.33, ver tamén Fig. 10.12).
Biosíntese de colesterol
A biosíntese do colesterol ten lugar no retículo endoplasmático. A fonte de todos os átomos de carbono na molécula é o acetil-SCoA, que vén aquí dos mitocondrios como parte do citrato, como na síntese de ácidos graxos. A biosíntese de colesterol consume 18 moléculas de ATP e 13 moléculas de NADPH.
A formación de colesterol prodúcese en máis de 30 reaccións, que se poden agrupar en varias etapas.
1. Síntese do ácido mevalónico.
As dúas primeiras reaccións de síntese coinciden coas reaccións de cetoxénese, pero despois da síntese de 3-hidroxi-3-metilglutarilo-ScoA, a enzima entra hidroximetil-glutarilo-ScoA reductasa (HMG-SCOA reductasa), formando ácido mevalónico.
 |
Esquema de reacción de síntese de colesterol2. Síntese de isopentenil difosfato. Nesta fase, tres residuos de fosfato están unidos ao ácido mevalónico, logo é descarboxilado e deshidroxenado. 3. Despois de combinar as tres moléculas de isopentenil difosfato, sintetízase o farnesil difosfato. 4. A síntese de squalene prodúcese cando se enlazan dous residuos de farnesil difosfato. 5. Despois de reaccións complexas, o squaleno lineal cicúlase ao lanosterol. 6. A eliminación do exceso de grupos metilo, a restauración e a isomerización da molécula leva á aparición de colesterol. Regulación da actividade da hidroximetilglutaril-S-CoA reductasa3. A taxa de biosíntese do colesterol tamén depende da concentración proteína portadora específicaque prevé a unión e transporte de metabolitos de síntese intermedia hidrofóbicos. Podes preguntar ou deixar a túa opinión. O principal punto de regulación é a reacción da formación de ácido mevalónico. 1. Regulación alostérica. O colesterol e no fígado e os ácidos biliares inhiben a HMG-CoA reductasa. 2. Represión da síntese do colesterol HMG-CoA reductasa. 3. Regulación por fosforilación-desfosforilación de HMG-CoA reductasa, forma activa non fosforilada. O glágono provoca desactivación e a insulina provoca a activación a través dunha complexa cascada de reaccións. Así, a taxa de síntese de colesterol cambia cun cambio nos estados absorbentes e postabsorción. 4. A taxa de síntese de HMG-CoA reductasa no fígado está suxeita a claras fluctuacións diúrnas: máxima a media noite e mínima pola mañá. Intercambio de ésteres de colesterol Nas células A esterificación do colesterol ocorre cando está exposta acil-CoA-colesterol-aciltransferase (AHAT): Acilo-CoA + Colesterol ® NS-CoA + Aciclolesterol Nas células fórmase principalmente linoleilcolesterol. Os ésteres atópanse principalmente no citosol como parte das pingas lipídicas. A formación de ésteres pode considerarse, por un lado, como un mecanismo para eliminar o exceso de colesterol das membranas e, por outra banda, como un mecanismo para almacenar o colesterol na célula. A mobilización de reservas prodúcese coa participación de encimas esterasehidrólise de ésteres de colesterol: Aciclolesterol + N2O ® Ácido graxo + Colesterol A síntese e hidrólise de ésteres é especialmente activa nas células da corteza suprarrenal. Nas lipoproteínas do sangue A formación de éster prodúcese coa participación de lecitina-colesterol-aciltransferase (LHAT), que cataliza a transferencia do residuo acilo da lecitina ao colesterol. O LHAT está formado no fígado, secretado no torrente sanguíneo e unido a lipoproteínas. O LHAT máis activo en HDL, onde está localizado na capa superficial. Os ésteres de colesterol formados aquí son hidrofóbicos e inmersos no núcleo lipídico. Na capa de fosfolípidos hai espazo libre para o colesterol, que se pode encher con colesterol das membranas celulares ou doutras lipoproteínas. Así, o HDL parece ser unha trampa de colesterol como resultado da acción do LHAT. Síntese de ácido biliar No fígado, parte do colesterol convértese en ácidos biliares. Os ácidos biliares poden considerarse como derivados do ácido colánico. O ácido colanico como tal non está formado no corpo. Nos hepatocitos do colesterol fórmanse ácidos biliares primarios - chenodeoxicolóxico e chólico. Despois da secreción de bile no intestino baixo a acción de encimas da flora intestinal, fórmanse ácidos biliares secundarios a partir deles - litocólico e desoxicolóxico. Son absorbidos polos intestinos, co sangue da vea portal entra no fígado e logo na bile. A bile contén principalmente ácidos biliares conxugados, é dicir, os seus compostos con glicina ou taurina. A concentración de ácidos biliares na bilis é de aproximadamente o 1%. A parte principal dos ácidos biliares está implicada circulación hepatoentérica.Unha pequena porción de ácidos biliares - uns 0,5 g por día - excrétase nas feces. Isto compénsase coa síntese de novos ácidos biliares no fígado, o fondo de ácidos biliares actualízase nuns 10 días. O colesterol tamén se excreta principalmente a través dos intestinos. Entra nos intestinos cos alimentos e polo fígado como parte da bilis. O colesterol absorbido no sangue contén unha fracción orixinaria da bilis (colesterol endóxenosintetizado no fígado) e a fracción derivada dos alimentos (colesterol exóxeno) A eliminación do colesterol dos tecidos prodúcese pola súa oxidación a ácidos biliares no fígado, seguida da súa excreción con feces (aproximadamente 0,5 g por día) e pola excreción de colesterol non modificado (tamén con feces). En estado estacionario: (Colesterolfinal + Colesterolex) - (Colesterolexcre + Ácidos biliaresexcre) = 0 Se perturba este equilibrio, a concentración de colesterol nos tecidos e no sangue cambia. Aumento do colesterol no sangue hipercolesterolemia. Isto aumenta a probabilidade de aterosclerose e enfermidade de cálculos biliares. REGULAMENTO DE CAMBIO LÍPIDO O metabolismo dos lípidos está regulado polo sistema nervioso central. De longa duración estrés emocional negativoUn aumento da liberación de catecolaminas no torrente sanguíneo pode causar unha perda de peso notable. Acción glucagón no sistema lipolítico é semellante á acción das catecolaminas. Adrenalina e noradrenalina aumenta a actividade da lipase tisular e a taxa de lipólise no tecido adiposo, como resultado, aumenta o contido de ácidos graxos no plasma sanguíneo. Insulina ten o efecto contrario á adrenalina e ao glucagón na lipólise e na mobilización de ácidos graxos. Hormona do crecemento estimula a lipólise, inducindo a síntese de acenilato ciclase. A hipofunción pituitaria leva á deposición de graxa no corpo (obesidade pituitaria). Tiroxina, hormonas sexuaistamén afectan o metabolismo dos lípidos. A eliminación das glándulas sexuais nos animais provoca un exceso de deposición de graxa. TRASTORNOS DO CAMBIO LÍPIDO O colesterol é un esteroide específico para organismos animais. O lugar principal da súa formación no corpo humano é o fígado, onde se sintetiza o 50% do colesterol, o 15-20% fórmase no intestino delgado, o resto sintetízase na pel, a córtex suprarrenal e as gónadas. Na fonte 22.1 as fontes da formación do fondo de colesterol e as formas de gasto están presentadas. Fig. 22.1. A formación e distribución do colesterol no corpo. O colesterol do corpo humano (cantidade total de aproximadamente 140 g) pódese dividir condicionalmente en tres pozos: 30 g), intercambiando rapidamente, consta de colesterol da parede intestinal, plasma sanguíneo, fígado e outros órganos parénquimais, a renovación ocorre en 30 días (1 g / día), 50 g), cambiando lentamente o colesterol doutros órganos e tecidos, 60 g), un colesterol moi lento da medula espiñal e do cerebro, tecido conectivo, a taxa de actualización calcúlase co paso dos anos. A síntese do colesterol prodúcese no citosol das células. Esta é unha das vías metabólicas máis longas do corpo humano. Continúa en 3 etapas: a primeira remata coa formación de ácido mevalónico, a segunda coa formación de squaleno (estrutura lineal de hidrocarburos formada por 30 átomos de carbono). Durante a terceira etapa, o squaleno convértese nunha molécula de lanosterol, entón hai 20 reaccións sucesivas que converten o lanosterol en colesterol. Nalgúns tecidos, o grupo hidroxilo do colesterol esterifica para formar ésteres. A reacción está catalizada pola encima intracelular AHAT (acylCoA: colesterol aciltransferase). A reacción de esterificación tamén se produce no sangue en HDL, onde se atopa o encima LHAT (lecitina: colesterol aciltransferase). Os ésteres de colesterol son a forma na que é transportada por sangue ou depositada nas células. No sangue, aproximadamente o 75% do colesterol ten forma de ésteres. A síntese de colesterol está regulada afectando á actividade e á cantidade da enzima clave do proceso - 3-hydroxy-3-metilglutaryl-CoA reductase (HMG-CoA reductase). Isto pódese conseguir de dúas formas: 1. Fosforilación / desfosforilación de HMG-CoA reductasa. A insulina estimula a defosforilación da HMG-CoA reductasa, traducíndoa a un estado activo. Polo tanto, no período de absorción aumenta a síntese do colesterol. Durante este período, tamén aumenta a dispoñibilidade do substrato inicial para a síntese, acetil-CoA. O glágono ten o efecto contrario: a través da proteína quinase A, estimula a fosforilación da HMG-CoA reductasa, converténdoa nun estado inactivo. Como resultado, inhibe a síntese de colesterol no período de posabsorción e durante o xaxún. 2. Inhibición da síntese de HMG-CoA reductasa.O colesterol (produto final da vía metabólica) reduce a taxa de transcrición do xene HMG-CoA reductasa, inhibindo así a súa propia síntese e os ácidos biliares tamén causan un efecto similar. O transporte de colesterol no sangue realízase como parte da droga. Os LP proporcionan colesterol exóxeno nos tecidos, determinan os seus fluxos entre os órganos e a excreción do corpo. O colesterol exóxeno entrégase no fígado como parte da CHM residual. Alí, xunto co colesterol endóxeno sintetizado, forma un fondo común. Nos hepatocitos, as TAG e o colesterol son envasados en VLDL, e deste xeito secrétanse no sangue. Baixo a influencia da LP-lipasa, hidrolizando TAG a glicerol e ácidos graxos no sangue, os VLDLPs convértense primeiro en STLPs e logo en LDLPs que conteñen ata o 55% de colesterol e os seus ésteres. O LDL é a principal forma de transporte do colesterol na que se entrega aos tecidos (o 70% do colesterol e os seus ésteres no sangue forman parte da LDL). O LDL do sangue entra no fígado (ata o 75%) e outros tecidos que teñen receptores de LDL na súa superficie. Se a cantidade de colesterol que entra na célula supera a súa necesidade, entón suprímese a síntese de receptores de LDL, o que reduce o fluxo de colesterol do sangue. Cun descenso na concentración de colesterol libre na célula, ao contrario, actívase a síntese do receptor. As hormonas están implicadas na regulación da síntese dos receptores LDL: a insulina, a triiodotironina e as hormonas sexuais aumentan a formación de receptores e diminúen os glucocorticoides. No chamado "transporte de retorno do colesterol", i.e. a vía que asegura o regreso do colesterol ao fígado, o HDL xoga o papel principal. Sintetízanse no fígado en forma de precursores inmaduros que practicamente non conteñen colesterol e TAG. Os precursores do HDL no sangue están saturados de colesterol, recibíndoo doutros LPs e membranas celulares. A transferencia de colesterol a HDL implica a encima LHAT situada na súa superficie. Esta enzima atribúe un residuo de ácidos graxos da fosfatidilcolina (lecitina) ao colesterol. Como resultado, fórmase unha molécula hidrófoba de éster de colesterol, que se move no HDL. Así, o HDL non borracho, enriquecido con colesterol, convértese en HDL 3 - partículas maiores e maiores HDL 3 intercambian ésteres de colesterol por TAG contidos en VLDL e STD coa participación dunha proteína específica que transfire os ésteres de colesterol entre lipoproteínas. Neste caso, HDL 3 convértese en HDL2, cuxo tamaño aumenta debido á acumulación de TAG. A VLDL e a STDL baixo a influencia da LP-lipase convértense en LDL, que principalmente proporcionan colesterol ao fígado. Unha pequena porción de colesterol é entregada ao fígado de HDL2 e HDL. Síntese de ácidos biliares. No fígado, sintetízanse de 500 a 700 mg de ácidos biliares por día a partir do colesterol. A súa formación inclúe reaccións da introdución de grupos hidroxilo coa participación de hidroxilases e a reacción de oxidación parcial da cadea lateral do colesterol (Fig. 22.2): Fig. 22.2. Esquema de formación de ácidos biliares. A primeira reacción de síntese -a formación de 7-a-hidroxicolesterol- é reguladora. A actividade do encima que cataliza esta reacción é inhibida polo produto final da vía, os ácidos biliares. Outro mecanismo de regulación é a fosforilación / desfosforilación do encima (a forma fosforilada da 7-a-hidroxilase está activa). A regulación tamén é posible cambiando a cantidade do encima: o colesterol induce a transcrición do xene 7-a-hidroxilase e os ácidos biliares reprimen. As hormonas tiroides inducen a síntese de 7-a-hidroxilase e a represión de estróxenos. Tal efecto do estróxeno na síntese de ácidos biliares explica por que a enfermidade do cálculo biliar ocorre en mulleres 3-4 veces máis veces que nos homes. Os ácidos crólicos e chenodeoxicolicos formados a partir do colesterol denomínanse "ácidos biliares primarios". A maior parte destes ácidos sofre conxugación: a adición de moléculas de glicina ou taurina ao grupo carboxilo do ácido biliar. A conxugación comeza coa formación da forma activa de ácidos biliares - derivados de CoA, logo únense a taurina ou a glicina e, como resultado, fórmanse 4 variantes de conxugados: ácidos taurocolóxicos e taurohenodeoxicólicos, glicocolólicos e glicohenodeoxicólicos. Son emulsionantes significativamente máis fortes que os ácidos biliares orixinais. Os conxugados coa glicina fórmanse 3 veces máis que coa taurina, xa que a cantidade de taurina no corpo é limitada. No intestino, unha pequena cantidade de conxugados de ácidos biliares primarios baixo a acción de encimas bacterianas convértense en ácidos biliares secundarios. O ácido desoxicólico, formado a partir de cola e litocólico, formado a partir de desicocólicos, son menos solubles e absorbense máis lentamente nos intestinos. Ao redor do 95% dos ácidos biliares que entran no intestino volven ao fígado pola vea portal, logo volven ser secretados na bilis e reutilizados na emulsificación de graxas. Esta vía de ácidos biliares denomínase circulación enterohepática. Con feces, os ácidos biliares secundarios elimínanse na súa maioría. A enfermidade do cálculo biliar (colelitiasis) é un proceso patolóxico no que se forman pedras na vesícula biliar, cuxa base é o colesterol. A liberación de colesterol na bilis debería ir acompañada dunha liberación proporcional de ácidos biliares e fosfolípidos que manteñen as moléculas de colesterol hidrofóbicas no estado micelar. As razóns que conducen a un cambio na relación de ácidos biliares e colesterol na bilis son: alimentos ricos en colesterol, nutrición rica en calorías, estancamento da bilis na vesícula biliar, deterioración da circulación enterohepática, síntese deteriorada de ácidos biliares, infección da vesícula biliar. Na maioría dos pacientes con colelitiasis, aumenta a síntese de colesterol e diminúe a síntese de ácidos biliares, o que conduce a unha desproporción no número de colesterol e ácidos biliares secretados na bilis. Como resultado, o colesterol comeza a precipitarse na vesícula biliar, formando un precipitado viscoso que se endurece gradualmente. Ás veces está impregnado de bilirrubina, proteínas e sales de calcio. As pedras poden consistir só en colesterol (pedras de colesterol) ou nunha mestura de colesterol, bilirrubina, proteínas e calcio. As pedras de colesterol adoitan ser brancas e as pedras mesturadas son marróns de diferentes tons. Na etapa inicial da formación de pedra, o ácido chenodeoxicólico pode usarse como medicamento. Unha vez na vesícula, disólvese gradualmente as pedras de colesterol, pero este é un proceso lento que dura varios meses. A aterosclerose é unha patoloxía caracterizada pola aparición de placas ateróxenas na superficie interna da parede vascular. Un dos motivos principais para o desenvolvemento de tal patoloxía é a violación do equilibrio entre a inxestión de colesterol dos alimentos, a súa síntese e a excreción do corpo. Os pacientes con aterosclerose teñen concentracións elevadas de LDL e VLDL. Existe unha relación inversa entre a concentración de HDL e a probabilidade de desenvolver aterosclerose. Isto é consistente co concepto do funcionamento do LDL como portadores de colesterol nos tecidos e HDL dos tecidos. O "requisito previo" metabólico básico para o desenvolvemento da aterosclerose é a hipercolesterolemia. (colesterol alto no sangue). A hipercolesterolemia desenvolve: 1. debido ao exceso de inxestión de colesterol, carbohidratos e graxas, 2. predisposición xenética consistente en defectos hereditarios na estrutura dos receptores de LDL ou apoB-100, así como no aumento da síntese ou secreción de apoB-100 (no caso de hiperlipidemia combinada familiar, na que as concentracións de sangue e colesterol e TAG son elevadas). A modificación do medicamento xoga un papel importante nos mecanismos do desenvolvemento da aterosclerose. Os cambios na estrutura normal dos lípidos e proteínas no LDL fan que sexan estranxeiros ao corpo e polo tanto sexan máis accesibles para a súa captura por fagocitos. A modificación de medicamentos pode producirse por varios mecanismos: 1. Glicosilación de proteínas que se produce cando aumenta a concentración de glicosa no sangue, 2. modificación do peróxido, que produce cambios nos lípidos nas lipoproteínas e na estrutura de apoB-100, 3. a formación de complexos autoinmunes do anticorpo LP (os medicamentos alterados poden provocar a formación de anticorpos). A LDL modificada é absorbida por macrófagos. Este proceso non está regulado pola cantidade de colesterol absorbido, como no caso da súa entrada en células a través de receptores específicos, polo tanto os macrófagos están sobrecargados de colesterol e convértense en "células escumosas" que penetran no espazo subendotelial. Isto leva á formación de manchas ou tiras lipídicas na parede dos vasos sanguíneos. Nesta fase, o endotelio vascular pode manter a súa estrutura. Con un aumento no número de células de escuma, prodúcese danos endoteliais. Os danos contribúen á activación das plaquetas. Como resultado, segregan tromboxano, o que estimula a agregación plaquetaria, e tamén comezan a producir un factor de crecemento plaquetario, que estimula a proliferación de células musculares lisas. Estas últimas migran desde a capa media á capa interna da parede arterial, contribuíndo así ao crecemento da placa. A continuación, a placa brota cun tecido fibroso, as células baixo a membrana fibrosa son necróticas e o colesterol deposítase no espazo intercelular. Nas últimas fases de desenvolvemento, a placa impregna con sales de calcio e faise moi densa. Na zona da placa, os coágulos de sangue adoitan formarse, bloqueando o lumen do vaso, o que leva a unha alteración circulatoria aguda no sitio de tecidos correspondente e ao desenvolvemento dun ataque cardíaco. A regulación da síntese de colesterol - a súa encima clave (HMG-CoA reductasa) realízase de diferentes xeitos. Fosforilación / desfosforilación de HMG reductasa. Cun aumento da relación insulina / glucagón, esta enzima se fosforila e pasa a estado activo. A acción da insulina realízase a través de 2 encimas. A fosfase da HMG-CoA reductasa quinasa, o que converte a quinasa nun estado desfosforilado inactivo: Fosfotase HMG-CoA reductasa converténdoa nun estado activo desfosforilado. O resultado destas reaccións é a formación dunha forma activa desfosforilada de HMG-CoA reductasa. En consecuencia, durante o período de absorción, o colesterol aumenta. Durante este período, a dispoñibilidade do substrato inicial para a síntese de colesterol - acetil - CoA aumenta (como resultado de comer alimentos que conteñen hidratos e graxas, xa que o acetilo CoA fórmase durante a descomposición de glicosa e ácidos graxos). No estado posabsorbente, o glucagón a través da proteingenase A estimula a fosforilación da HMG - CoA - reductasa, converténdoa nun estado inactivo. Esta acción vese reforzada polo feito de que o glucagón estimula ao mesmo tempo a fosforilación e a inactivación da fosfase da HMG-CoA reductasa, mantendo así a HMG-CoA reductasa nun estado fosforilado. Como resultado, a síntese de colesterol no período de posabsorción e durante o xaxún é inhibida por síntese endóxena. Se o contido de colesterol nos alimentos foi levado ao 2%, entón a síntese de colesterol endóxeno diminuíu drasticamente. Pero a cesación completa da síntese de colesterol non se produce. O grao de inhibición da biosíntese do colesterol baixo a influencia do colesterol procedente dos alimentos varía de persoa a persoa. Isto indica a individualidade dos procesos de formación do colesterol. Ao reducir a intensidade da síntese de colesterol, é posible reducir a súa concentración no sangue. Se o equilibrio entre a inxestión de colesterol con alimentos e a súa síntese no corpo por un lado e a excreción de ácidos biliares e colesterol por outro, a concentración de colesterol nos tecidos e o sangue cambia. As consecuencias máis graves están asociadas a un aumento da concentración de colesterol no sangue (hipercolesterolemia), mentres que a probabilidade de contraer aterosclerose e colelitiasis aumenta. A hipercolesterolemia familiar (HCS) - esta forma é moito máis común - aproximadamente 1 paciente por cada 200 persoas. Un defecto herdado do HCS é unha violación da absorción de LDL por células e, polo tanto, unha diminución da taxa de catabolismo LDL. Como resultado, a concentración de LDL no sangue aumenta, así como o colesterol xa que hai moita cantidade na LDL. Polo tanto, co HCS, é característica a deposición de colesterol nos tecidos, en particular na pel (xanthomas), nas paredes das arterias. Inhibición da síntese de HMG-CoA reductasa O produto final da vía metabólica do colesterol. Reduce a taxa de transcrición do xene HMG-CoA reductasa, inhibindo así a súa propia síntese. O fígado está sintetizando activamente ácidos biliares a partir do colesterol e, polo tanto, os ácidos biliares inhiben a actividade do xen HMG-CoA reductasa. Dado que a HMG-CoA reductasa existe despois da síntese de aproximadamente 3, a inhibición da síntese deste encima do colesterol é unha regulación eficaz. |