Hidratos de carbono: monosacáridos, polisacáridos
Hidratos de carbono, monosacáridos, polisacáridos. Os carbohidratos están moi estendidos no mundo animal e vexetal, desempeñan un papel excepcional en moitos procesos de vida. Os carbohidratos representan o 80% do peso seco das plantas e o 2% do peso seco dos organismos animais.
Título hidratos de carbono estas substancias naturais foron propostas en 1844 por C. Schmidt, porque a composición elemental dos hidratos de carbono coñecidos podería expresarse como Cn(N2Ah)m Actualmente, o concepto de hidratos de carbono fíxose moito máis amplo.
Os carbohidratos divídense normalmente en monosacáridos, oligosacáridos e polisacáridos.
Monosacáridos(monoses): substancias que non son capaces de someterse a hidrólise.
Oligosacáridos- substancias formadas a partir de varios residuos de moléculas de monosacáridos (de 2 a 8-10). O máis sinxelo destes son os disacáridos.
Polisacáridosson compostos de alto peso molecular cuxas macromoléculas están formadas a partir de moitas moléculas de monosacáridos.
Monosacáridos clasificados polo número de átomos de carbono na molécula e pola presenza do aldehido ou grupo cetona:
Tetrosa
Pentoses
Hexoses
Monosacáridos: aldoses, cetosas
Pola súa estrutura, os monosacáridos son polihidroxialdehidos ou polidroxicetonas:
Os monosacáridos obtéñense a partir dos polisacáridos por hidrólise destes últimos. Por exemplo, a hidrólise da remolacha ou do azucre de cana produce glicosa e fructosa:

Os monos son moi solubles en entrada, a maioría deles teñen un sabor doce, solucións de reacción neutra. Cando se quentan, póñense marróns e se carbonizan. Todos os monosacáridos naturais teñen actividade óptica.
De importancia biolóxica primaria son os azucres con 5 e 6 átomos de carbono na molécula (pentosas e hexoses). Pola súa estrutura divídense en dous grandes grupos: alcohóis aldehídos (aldoses) e alcohois ceto (cetosas):

Na actualidade, considérase establecido que nunha solución de azucre hai tanto moléculas cuxa estrutura está dada arriba (cadea ou forma aberta) como moléculas cunha estrutura cíclica (forma semicetal cíclica):

Por primeira vez, a forma cíclica para a monose foi proposta polo científico ruso A. A. Colly (1840-1916). Tamén realizou outros estudos sobre a química dos hidratos de carbono de gran importancia.
As formas cíclicas de hidratos de carbono pódense considerar derivados de dous tipos de compostos cíclicos: piran (anel de seis membros) ou furancho (anel de cinco membros):

En productos farmacéuticos, os monos úsanse principalmente para a glicosa como medicamento, a frutosa como substituto do azucre para pacientes con diabetes mellitus, úsanse dioses: sacarosa, lactosa, algúns oligosacáridos úsanse, por exemplo, como solucións de infusión, os polisacáridos son celulosa, amidóns de varias orixes. Os derivados de hidratos de carbono son moi empregados como medicamentos: glucosamina e o seu composto polimérico condroitina.
Glicosa glicosa.
Obtendo glicosa. En estado libre, a glicosa atópase no zume de uva, nas froitas e outros órganos de varias plantas. A principal fonte de produción de glicosa na industria é o almidón (e menos comunmente a celulosa), que se hidrolizan en presenza de ácidos minerais:
Estrutura química. A glucosa refírese ás aldosas, e ao número de átomos de carbono ás hexoses:
Unha característica estrutural importante dos monosacáridos é o seu isomerismo inherente. A glicosa contén varios átomos de carbono asimétricos, concretamente catro, e polo tanto caracterízase por isomerismo espacial (estereoisomerismo).
Se hai n centros asimétricos na molécula, no caso xeral, o número de isómeros espaciais exprésase coa fórmula 2 n.
2 4 = 16. Polo tanto, 16 estereoisómeros, 8 pares de antípodos (enantiómeros) son posibles para a glicosa.
Para indicar a estrutura espacial de cada un dos estereoisómeros, os carbohidratos (como outras substancias ópticamente activas), segundo a proposta de M. A. Rozanov, divídense en dúas filas: a fila D e a fila L. Os representantes máis sinxelos destes radas son os antípodos ópticos do aldehído glicerol:

O aldehído D-glicerol chamouse estereoisómero dextrorotador, que ten un grupo OH no lado dereito dun átomo de carbono asimétrico cando a cadea está escrita cara arriba polo grupo aldehído. O isómero L neste caso ten un grupo OH á esquerda. Este é un exemplo típico de isómeros ópticos.
Acepta a seguinte condición: as substancias que se poden obter do aldehído D-glicerol engadindo unha cadea de carbono ao grupo aldehído pertencen á serie D. Unha posición similar aplícase á liña L.
Os carbohidratos caracterízanse por un estado de equilibrio entre unha estrutura lineal e cíclica, e nos oligosacáridos teñen unha forma exclusivamente cíclica:

O grupo hidroxilo do quinto átomo de carbono achégase espacialmente ao grupo aldehído tendo en conta o valor do ángulo de valencia, isto conduce á formación dun hemiacetal cíclico interno. A ciclización leva á formación dun anel estable de seis membros, que se denomina piranosa.
O hidroxilo semi-acetal, á súa vez, fai posible:
1. Formule acetalos con outros azucres e compostos que conteñan NH2- e OH-.
2. Forma estruturas de polímeros.
Cando se forma un hemiacetal cíclico, o átomo de carbono do grupo carbonilo transfórmase nun asimétrico. Neste átomo de carbono asimétrico de recente formación, o átomo de hidróxeno e o grupo hidroxilo pódense organizar de dúas formas: esquerda-esquerda, OH-dereita e, pola contra, H-dereita, esquerda-OH. Estes isómeros que difiren na disposición do hidroxilo hemi-acetal denomínanse anómeros. Para distinguir entre anómeros, úsanse as seguintes convencións: α- e β-, α-Anomer ten un hidroxilo semi-acetal ao mesmo lado do grupo OH, o que indica que o monosacárido pertence á serie D- ou L, o β-anómero é viceversa.
A glicosa farmacopea é α-D-glicosa:
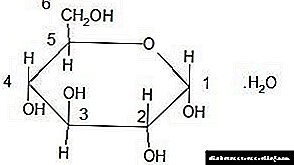
A auga de cristalización da glicosa representa o 10% da súa masa molar.
Propiedades. Po cristalino branco sen sabor, de sabor doce. Facilmente soluble en auga, difícil en alcol, practicamente insoluble en éter.
Autenticidade.
1. Definición organoléptica (sabor doce).
2. Interacción co reactivo Felling (a formación dun precipitado de óxido de cobre), Nessler (a formación dun precipitado de mercurio), a reacción dun espello de prata.
3. Cando se quenta con timol e ácido sulfúrico concentrado, fórmase unha cor vermella escura. Debido á deshidratación de azucre, fórmase o correspondente derivado furfural, que reacciona co timol para formar un colorante aurino:
4. Cando se quenta con resorcinol e ácido clorhídrico diluído, fórmase unha cor rosa.

5. A formación de azazonas con fenilhidrazina (precipitado cristalino amarelo):

Limpeza. A glicosa ten unha rotación específica, é dextrorotadora no FS. O intervalo de rotación específico está permitido, indícase o disolvente, a concentración da solución). Transparencia, cor, acidez, cloruros, sulfatos e calcio normalmente aceptados. Impurezas inadmisibles: bario, dextrano.
Determinación da rotación específica αD 20. A presenza de varios centros asimétricos na molécula de glicosa provoca actividade óptica cunha rotación pronunciada do plano da luz polarizada. Medindo o ángulo ao que xira a luz polarizada pódese calcular a rotación específica. Nas solucións de glicosa recén preparadas, prodúcese o fenómeno da chamada mutación, que supón un cambio na magnitude da rotación, alcanzando un valor constante ao cabo de certo tempo. A mutación pode explicarse polo feito de que ao disolverse a glicosa, que se atopa nun estado cristalino nunha forma cíclica, fórmase a súa forma aldehida, a través da cal se obtén formas cíclicas anómicas de glicosa: formas α- e β, que difiren na disposición de substituíntes no primeiro átomo de carbono, en conexión. co que teñen diferentes valores de rotación. A rotación específica é unha constante dunha sustancia ópticamente activa. A rotación específica determínase como o ángulo de rotación do plano de luz monocromática polarizada nunha lonxitude de percorrido de 1 dm nun medio que contén unha sustancia ópticamente activa, coa redución condicional da concentración desta sustancia a un valor de 1 g / ml.
A magnitude da rotación específica calcúlase:
α = (α · 100) / (l · c) (para solucións de substancias)
O fenómeno da mutación pódese acelerar engadindo amoníaco á solución de glicosa.
Cuantificación. Non se proporciona a determinación cuantitativa do artigo de farmacopea actual. En formas de inxección úsase refractometría. Entre os métodos non farmacopea empregados para a determinación cuantitativa da glicosa, destacan:
1. Iodométricométodo de valoración de volta, é dicir. valoración do exceso de iodo despois da oxidación. Método Willstatter. Nun medio alcalino ou carbonatado cun exceso de iodo, é oxidado a un ácido (glucónico). O iodo titúlase con tiosulfato de sodio.
2. Iodométricodespois da oxidación dos reactivos de Nessler.
3. Permanganatométrico(Método Bertrand). Método de valoración directa. O método está baseado na oxidación selectiva do grupo aldehído cun reactivo de Felling, seguido da adición de sal férrica á solución, que á súa vez está titulada con solución de permanganato de potasio.
Factor de equivalencia = 1/2.
4. Refractometríamétodo. Baseado no índice de refracción da solución de glicosa.
5. Polarimétricamétodo.
Aplicación. A glicosa úsase como fonte de organismos de carbohidratos facilmente digeribles. Usado en forma de solucións para administración intravenosa: 5%, 10%, 20% e 40%. En forma de comprimidos, 0,5 g e 1,0 g, así como en combinación con vitaminas e outras substancias.
Almacenamento. Nun recipiente ben pechado nun lugar seco.
Estabilización de solucións de glicosa.
As solucións de glicosa por inxección son moi empregadas e adoitan prepararse en farmacias. Ao elixir un estabilizador para a solución de glicosa, hai que ter en conta a natureza multifuncional desta sustancia. A glicosa é inestable nun ambiente alcalino, baixo a influencia do osíxeno, fórmanse hidróxidos: glicólico, levulinico, fórmico e hidroximetil furfural. Para evitar este proceso, as solucións de glicosa estabilizanse con 0,1 mol / L de solución HC1 ata un pH de 3,0-4,0. Comprobouse que a pH 3,0 hai unha formación mínima de 5-hidroximetilfurfural, o que ten un efecto nefrohepatotóxico. A glicosa é inestable nun ambiente ácido - o ácido D-glucónico e as súas lactonas fórmanse, como resultado da súa oxidación, especialmente durante a esterilización, fórmase 5-hidroximetilfur-fural, provocando un amarelado da solución.
As solucións de glucosa en GLF segundo GF X1 estabilizanse engadindo 0,2 g de NaCl por 1 litro de solución e 0,1 mol / L de solución de HCl a un pH de 3,0-4,0.
Actualmente, crese que NaCl en combinación con Hcl crea un sistema tampón estabilizador de glicosa en ambientes neutros e ácidos. Nunha farmacia, o estabilizador prepárase de acordo coa seguinte receita:
NaCl - 5,2 g.
Ácido clorhídrico diluído 4,4 ml
Auga para inxección ata 1 litro.
Na fabricación de solucións de glicosa, independentemente da súa concentración, engade o 5% deste estabilizador.
Oligosacáridos.Azucre en sacar.
Obter azucre da remolacha ou da cana de azucre. É un disacárido, consta de dous monosacáridos: D - (+) - glicosa e D - (-) - fructosa:

Descrición. Pezas sólidas brancas de estrutura cristalina, sen olor e sabor doce. Moi soluble en auga.
Refírese a azucres non reductores, porque non hai un grupo hidroxi semiacetal, non produce unha reacción cunha solución Felling e só é capaz de formar éteres e ésteres. A droga é facilmente hidrolizada en presenza de ácidos débiles incluso.
Autenticidade. O medicamento mestúrase cunha solución de Co (NO3)2 e solución NaOH, apareceu a mancha violeta. Con resorcinol e ácido clorhídrico diluído - tinción vermella.
A rotación específica é de +66,5 a + 66,8º (solución acuosa 10). O método de determinación cuantitativa é polarimétrico.
Aplicación. Como recheo en comprimidos e po, baseándose nel, prepáranse xaropes, empregados tanto como formas de dosificación como para a corrección do GLF.
Lactosa.Saccharum lactis.

4- (β-D-galactopiranosido) - D-glucopiranosa.
Descrición. Cristais brancos ou po branco cristalino, inodoro, sabor doce. Facilmente soluble en auga, case insoluble en éter e cloroformo.
Autenticidade.
1. Co reactivo de Felling, un precipitado amarelo converténdose nun vermello pardo.
2. Con resorcinol e ácido clorhídrico a temperatura elevada - tinción amarela.
3. Rotación específica de +52 a +53,2 (solución acuosa ao 5%).
Determinación cuantitativa.
1. Iodométrico
2. Polarimétrico.
Aplícase como recheo en GLF.
Polisacáridos.Amidón-amidón.
Obter almidón de cultivos e patacas. É unha mestura de polisacáridos coa fórmula xeral (C6N10Ah5)x. A molécula de almidón inclúe residuos de α-D-glucopiranosa, que difiren uns dos outros no grao de polimerización e a natureza dos enlaces. Os polisacáridos que compoñen amidón pódense dividir en dúas fraccións: amilosa e amilopectina. A amilosa ten unha estrutura principalmente lineal cunha masa molar de 30000-160000. A súa molécula está construída a partir de unidades α-D-glucopiranosa, pero están conectadas na posición 1 → 4:

A amilopectina é un polisacárido ramificado. Os bonos están nas posicións 1-4 e 1-6. A masa molar é de 100.000 a 1.000.000.

Derivados de hidratos de carbono. Glucosamina. É un amino derivado da glicosa. Unha fonte natural é a cuncha de cangrejo, os camaróns e outras preparacións que conteñen quitina. Obtido por hidrólise ácida dun oligosacárido - quitosano:

Úsase como axente antiinflamatorio e un fragmento estrutural de tecido cartilaxinoso para a súa reparación. Forma parte de moitas formas de dosificación e úsase de forma independente en forma de clorhidrato.
Condroitina. Oligoaminosacarido, que é un fragmento de cartilaxe. Úsase como medicamento en forma de comprimidos e pomadas.
Monosacáridos, disacáridos, polisacáridos: hidratos de carbono nos exemplos
Os monosacáridos e os disacáridos son hidratos de carbono simples que teñen un sabor doce.
É por esta razón que se chaman azucres. Non obstante, non todos os azucres teñen a mesma dozura.
Entran no corpo a través dos alimentos cando o menú dunha persoa contén produtos de orixe natural, como froitas, verduras e bagas.
Por regra xeral, a información sobre o contido total de azucre, glicosa, frutosa e sacarosa contén unha táboa especial na que figuran varios produtos.
Se os hidratos de carbono simples teñen un sabor doce, os carbohidratos complexos, que se denominan polisacáridos, non o fan.
Características da glicosa
- A glicosa é un monosacárido usado para construír polisacáridos vitais como celulosa, glicóxeno e amidón. Atópase en bagas, froitas e verduras, polas que entra no torrente sanguíneo.
- Os monosacáridos en forma de glicosa teñen a capacidade de ser absorbidos ao instante e por completo cando entran no tracto dixestivo. Despois de que a glicosa entra no sangue, comeza a penetrarse en todos os tecidos e órganos internos, onde se produce unha reacción oxidativa, que fai que se libere enerxía.
 Para as células do cerebro, a glicosa é a única fonte de enerxía, polo que, coa falta de hidratos de carbono no corpo, o cerebro comeza a sufrir.
Para as células do cerebro, a glicosa é a única fonte de enerxía, polo que, coa falta de hidratos de carbono no corpo, o cerebro comeza a sufrir.
O nivel de glicosa no sangue depende do apetito e do comportamento nutricional dunha persoa.
Se os monosacáridos se concentran en grandes cantidades, pódese observar aumento de peso ou obesidade.
Características da frutosa
- Os hidratos de carbono simples, que son frutosa, cando se absorben nos intestinos, son absorbidos o dobre de glucosa. Ao mesmo tempo, os monosacáridos teñen a peculiaridade de manterse no fígado por moito tempo.
- Cando se produce o metabolismo celular, a fructosa convértese en glicosa. Mentres tanto, o nivel de azucre no sangue non aumenta drasticamente, pero hai un aumento suave e gradual dos indicadores. Este comportamento non require liberación instantánea da dose requirida de insulina, en relación con isto, a carga no páncreas é reducida.
- En comparación coa glicosa, a fructosa convértese facilmente e ácidos graxos, o que provoca a deposición de graxa. Segundo os médicos, moitos diabéticos gañan peso despois de consumir alimentos con alta frutosa. Debido á excesiva concentración de péptidos C no sangue, existe o risco de desenvolver resistencia á insulina, o que leva á aparición de diabetes mellitus tipo 2.
- Os monosacáridos como a fructosa pódense atopar en froitas e froitos frescos. Incluíndo este azucre pode conter polisacáridos de frutosa, que contén achicoria, alcachofa de Xerusalén e alcachofa.
Outros hidratos de carbono simples
Unha persoa recibe galactosa a través do azucre do leite, que se denomina lactosa. Na maioría das veces pódese atopar en iogures e outros produtos fermentados de orixe láctea. Despois de entrar no fígado, a galactosa convértese en glicosa.
 Os disacáridos prodúcense normalmente industrialmente. O produto máis famoso é a sacarosa ou o azucre regular, que mercamos nas tendas. Faise a partir de remolacha e cana de azucre.
Os disacáridos prodúcense normalmente industrialmente. O produto máis famoso é a sacarosa ou o azucre regular, que mercamos nas tendas. Faise a partir de remolacha e cana de azucre.
Incluíndo sacarosa que se atopa en melóns, sandías, algúns vexetais e froitas. Estas substancias teñen a capacidade de dixerir facilmente e desintegrarse instantaneamente en fructosa e glicosa.
Dado que hoxe en día úsanse disacáridos e monosacáridos na preparación de moitos pratos e forman parte da parte principal dos produtos, existe un alto risco de comer unha cantidade excesiva de hidratos de carbono. Isto leva a que o nivel de insulina dunha persoa aumente no sangue, se depositen células de graxa e se altere o perfil lipídico do sangue.
Todos estes fenómenos poden levar ao desenvolvemento de diabetes mellitus, obesidade, aterosclerose e outras enfermidades baseadas nestas patoloxías.
- Como xa sabedes, para o pleno desenvolvemento dos nenos necesitan hidratos de carbono sinxelos. Neste caso, os disacáridos como a lactosa son a súa principal fonte, formando parte dos produtos que conteñen leite.
- Dado que a dieta dun adulto é máis ampla, a falta de lactosa compénsase coa utilización doutros produtos. Ademais, non se recomenda unha gran cantidade de leite para adultos, xa que a actividade da encima lactosa, que descompón estes disacáridos, diminúe coa idade.
- Se non, pode producirse un trastorno dispeptico por intolerancia aos produtos lácteos. Se no canto do leite introdúcese na dieta kefir, iogures, crema de leite, queixo ou cottage, podes evitar unha perturbación no corpo.
- Como resultado da ruptura do polisacárido no tracto gastrointestinal fórmase maltosa. Ademais, estes disacáridos chámanse azucre de malta. Forman parte de mel, malta, cervexa, melaza, repostería e produtos de panadaría, nos que se engade melaza. Despois da inxestión de maltosa, sepáranse ata dúas moléculas de glicosa.
- O sorbitol é unha forma restaurada de glicosa que mantén o azucre no sangue, non causa fame e non causa unha carga de insulina. O sorbitol ten un sabor doce e é moi utilizado na fabricación de produtos para diabéticos. Non obstante, tales alcoholes polihídricos teñen a desvantaxe de afectar o funcionamento dos intestinos, provocando un efecto laxante e formación de gas.
Polisacáridos e as súas características
 Os polisacáridos son hidratos de carbono complexos, que inclúen numerosos monosacáridos, entre os que a glicosa se atopa con máis frecuencia. Estes inclúen fibra, glicóxeno e amidón.
Os polisacáridos son hidratos de carbono complexos, que inclúen numerosos monosacáridos, entre os que a glicosa se atopa con máis frecuencia. Estes inclúen fibra, glicóxeno e amidón.
A diferenza dos mono e disacáridos, os polisacáridos non teñen características específicas de penetración nas células. Unha vez no tracto dixestivo, descomponse. Como excepción, a fibra non é dixerida.
Por este motivo, non forma carbohidratos, senón que contribúe ao funcionamento normal dos intestinos.
Os carbohidratos atópanse en gran cantidade en almidón, por este motivo actúa como a súa principal fonte. O amidón é un nutriente que se deposita no tecido vexetal. Gran cantidade dela atópase en cereais e leguminosas. Debido ao seu valor nutritivo, o almidón considérase unha sustancia útil.
A esencia e o proceso de formación de hidratos de carbono, as súas funcións. Caracterización de monosacáridos: clasificación, isomerismo, propiedades físicas e químicas, derivados, fontes. Separación de hidratos de carbono complexos en oligosacáridos e polisacáridos, a súa estrutura e tipos.
| Título | Química |
| Ver | conferencia |
| Lingua | Ruso |
| Data engadida | 21.03.2013 |
| Tamaño do ficheiro | 1,1 M |

Documentos similares
Os carbohidratos como grupo de polihidroxialdehídos naturais, a súa estrutura e propiedades químicas, clasificación e tipos: monosacáridos, oligosacáridos e polisacáridos. Ciclo de glicólise e Krebs. Regulación do metabolismo dos carbohidratos. Intolerancia hereditaria á fructosa.
papel a prazo 422,5 K, engadido o 07/03/2015
Clasificación dos hidratos de carbono (monosacáridos, oligosacáridos, polisacáridos) como compostos orgánicos máis comúns. Propiedades químicas dunha sustancia, o seu papel na nutrición como principal fonte de enerxía, característica e lugar de glicosa na vida humana.
Resumo 212,0 K, engadido o 20 de decembro de 2010
A estrutura dos hidratos de carbono. O mecanismo de transferencia transmembrana de glicosa e outros monosacáridos na célula. Monosacáridos e oligosacáridos. O mecanismo de absorción de monosacáridos no intestino. Fosforilación da glicosa. Desfosforilación de glicosa-6-fosfato. Síntese de glicóxeno.
presentación 1,3 M, engadido o 22/12/2014
Funcións e clasificación de hidratos de carbono - compostos polifuncionais. Monosacáridos: pentosas: ribosa, desoxiribosa. Monosacáridos - hexoses: glicosa, frutosa. Disacáridos: sacarosa. Maltosa (azucre de malta). Polisacáridos: almidón, celulosa (fibra).
presentación 935,8 K, engadido o 17/03/2015
Materia orgánica que contén carbono, osíxeno e hidróxeno. A fórmula xeral para a composición química dos hidratos de carbono. A estrutura e as propiedades químicas dos monosacáridos, disacáridos e polisacáridos. As principais funcións dos hidratos de carbono no corpo humano.
presentación 1,6 M, engadido o 23/10/2016
Fórmula de hidratos de carbono, a súa clasificación. As principais funcións dos hidratos de carbono. Síntese de hidratos de carbono a partir do formaldehído. Propiedades dos monosacáridos, disacáridos, polisacáridos. Hidrólise do amidón por encimas contidas na malta. Fermentación alcohólica e láctica.
Presentación 487,0 K, engadido o 20/01/2015
A fórmula xeral dos hidratos de carbono, a súa importancia bioquímica primaria, a prevalencia na natureza e o papel na vida humana. Tipos de hidratos de carbono por estrutura química: sinxelos e complexos (mono e polisacáridos). O produto da síntese de hidratos de carbono a partir do formaldehído.
traballo de control 602,6 K, engadido 24/01/2011
Os carbohidratos como substancias orgánicas, cuxas moléculas están compostas por átomos de carbono, hidróxeno e osíxeno, familiaridade coa clasificación: oligosacáridos, polisacáridos. Caracterización de representantes de monosacáridos: glicosa, azucre da froita, desoxiribosa.
Presentación 1,6 M, engadido o 18/03/2013
O estudo da estrutura, clasificación e propiedades fisicoquímicas dos hidratos de carbono. O papel dos monosacáridos no proceso de respiración e fotosíntese. O papel biolóxico da fructosa e a galactosa. O papel fisiolóxico da aldosa ou cetosa. Propiedades físicas e químicas dos monosacáridos.
papel prazo 289,2 K, engadido o 28/11/2014
Clasificación, propiedades físicas e químicas dos polisacáridos. Hidrólise do amidón por encimas e ácidos. Plantas medicinais e materias primas que conteñen polisacáridos (homoglicósidos, poliosos, glicanos, holosidas). Aplicación na práctica médica.
Resumo 84,2 K, engadido o 23/08/2013