Galvus Met® (Galvus Met)
| Comprimidos recubertos con película | 1 lapela. |
| substancias activas: | |
| vildagliptin | 50 mg |
| clorhidrato de metformina | 500 mg |
| 850 mg | |
| 1000 mg | |
| excipientes: hiprolosa - 49,5 / 84,15 / 99 mg, estearato de magnesio - 6,5 / 9,85 / 11 mg, hipromellosa - 12,858 / 18,58 / 20 mg, dióxido de titanio (E171) - 2,36 / 2, 9 / 2,2 mg, macrogol 4000 - 1,283 / 1,86 / 2 mg, talco - 1,283 / 1,86 / 2 mg, amarelo de óxido de ferro (E172) - 0,21 / 0,82 / 1,8 mg, óxido de ferro vermello (E172) - 0,006 mg / - / - |
Descrición da forma de dosificación
Tabletas, 50 mg + 500 mg: ovalado, con bordos biselados, cuberto cunha membrana de película de amarelo amarelo cunha lixeira cor rosada. A marca NVR está nun lado e LLO no outro.
Tabletas, 50 mg + 850 mg: ovalado, con bordos biselados, cuberto cunha membrana de película amarela cunha débil tinte grisáceo. Dun lado está a marca “NVR”, do outro - “SEH”.
Tabletas, 50 mg + 1000 mg: ovalado, con bordos biselados, cuberto cunha membrana de película de amarelo escuro cunha tonalidade grisáceo. Hai unha marca "NVR" por un lado e "FLO" polo outro.
Farmacodinámica
A composición do medicamento Galvus Met inclúe 2 axentes hipoglucémicos con diferentes mecanismos de acción: vildagliptina, pertencente á clase de inhibidores de dipeptidil peptidase-4 (DPP-4), e metformina (en forma de clorhidrato), representante da clase de biguanidas. A combinación destes compoñentes permítelle controlar con maior eficacia a concentración de glicosa en pacientes con diabetes tipo 2 durante 24 horas.
Vildagliptin, un representante da clase de estimuladores do aparello pancreático insular, inhibe selectivamente o encima DPP-4, que destrúe o péptido tipo glucagón tipo 1 (GLP-1) e o polipéptido insulinotrópico dependente da glicosa (HIP).
A metformina reduce a produción de glicosa polo fígado, reduce a absorción de glicosa no intestino e reduce a resistencia á insulina, aumentando a captación e utilización de glicosa por tecidos periféricos.
A metformina induce a síntese intracelular do glicóxeno actuando sobre a glicóxena sintasa e aumenta o transporte de glicosa por certas proteínas transportadoras de glucosa en membrana (GLUT-1 e GLUT-4).
A rápida e completa inhibición da actividade de DPP-4 despois da vildagliptina provoca un aumento da secreción basal e alimentaria de GLP-1 e HIP do intestino á circulación sistémica ao longo do día.
Aumentando a concentración de GLP-1 e HIP, a vildagliptina provoca un aumento na sensibilidade das células β pancreáticas á glicosa, o que conduce a unha mellora da secreción de insulina dependente da glicosa. O grao de mellora da función das células β depende do grao do seu dano inicial, polo que en individuos sen diabetes mellitus (cunha concentración normal de glicosa no plasma sanguíneo), a vildagliptina non estimula a secreción de insulina e non reduce a concentración de glicosa.
Ao aumentar a concentración de GLP-1 endóxeno, a vildagliptina aumenta a sensibilidade das células α á glicosa, o que conduce a unha mellora da regulación dependente da glicosa da secreción de glucagón. Unha diminución da concentración elevada de glucagón despois das comidas, á súa vez, provoca unha diminución da resistencia á insulina.
Un aumento da relación insulina / glucágono fronte ao hiperglucemia debido ao aumento da concentración de GLP-1 e HIP provoca unha diminución da produción de glicosa por parte do fígado tanto durante as comidas como despois, o que conduce a unha diminución da concentración de glicosa no plasma sanguíneo.
Ademais, no fondo do uso de vildagliptin, notouse unha diminución da concentración de lípidos no plasma sanguíneo despois dunha comida, con todo, este efecto non está asociado ao seu efecto sobre GLP-1 ou HIP e unha mellora da función das illas pancreáticas.
Sábese que un aumento da concentración de GLP-1 pode levar a un baleiro máis lento do estómago, con todo, no fondo do uso de vildagliptina, non se observa un efecto similar.
Ao usar vildagliptina en 5759 pacientes con diabetes mellitus tipo 2 durante 52 semanas como monoterapia ou en combinación con metformina, derivados de sulfonilurea, tiazolidinione ou insulina, observouse unha diminución significativa a longo prazo da concentración de hemoglobina glicada (НbА).1s) e glicosa en sangue.
A metformina mellora a tolerancia á glicosa en pacientes con diabetes tipo 2 ao reducir as concentracións de glucosa no plasma tanto antes como despois das comidas.
A diferenza dos derivados da sulfonilurea, a metformina non causa hipoglucemia en pacientes con diabetes mellitus tipo 2 ou en individuos sans (excepto en casos especiais). A terapia coa droga non conduce ao desenvolvemento de hiperinsulinemia. Co uso de metformina, a secreción de insulina non cambia, mentres que as concentracións de insulina no plasma nun estómago baleiro e durante o día poden diminuír.
Cando se usa metformina, obsérvase un efecto beneficioso sobre o metabolismo das lipoproteínas: unha diminución na concentración de colesterol total, colesterol LDL e triglicéridos, non asociado co efecto da droga na concentración de glicosa no plasma sanguíneo.
Cando se usa terapia combinada con vildagliptina e metformina en doses diarias de 1.500-3.000 mg de metformina e 50 mg de vildagliptina 2 veces ao día durante 1 ano, observouse unha diminución persistente estatisticamente significativa da concentración de glicosa no sangue (determinada por unha diminución do índice de HbA.1s) e un aumento da proporción de pacientes que presentan unha diminución da concentración de HbA1s ascendeu a polo menos 0,6-0,7% (en comparación co grupo de pacientes que continuaron recibindo só metformina).
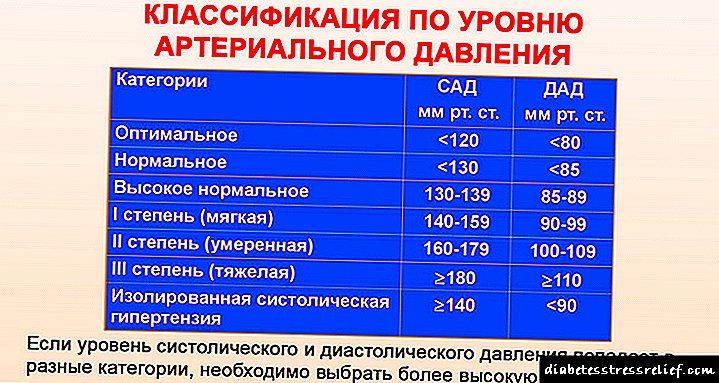
En pacientes que recibiron unha combinación de vildagliptina e metformina, non se observou un cambio estadísticamente significativo no peso corporal en comparación co estado inicial. 24 semanas despois do inicio do tratamento, nos grupos de pacientes que recibían vildagliptina en combinación con metformina, houbo unha diminución da presión arterial e papá en pacientes con hipertensión arterial.
Cando se usa unha combinación de vildagliptina e metformina como tratamento inicial para pacientes con diabetes mellitus tipo 2, observouse unha diminución dependente da dose de HbA durante 24 semanas1s en comparación coa monoterapia con estes fármacos. Os casos de hipoglucemia foron mínimos en ambos os grupos de tratamento.
Cando se usa vildagliptin (50 mg 2 veces ao día) con / sen metformina en combinación con insulina (dose media - 41 PIECES) en pacientes nun estudo clínico, o indicador HbA1s diminuíu estatisticamente de forma significativa - un 0,72% (indicador inicial - unha media do 8,8%). A incidencia de hipoglucemia no grupo tratado foi comparable á incidencia de hipoglucemia no grupo placebo.
Cando se usa vildagliptin (50 mg 2 veces ao día) xunto con metformina (≥1500 mg) en combinación con glimepirida (≥4 mg / día) en pacientes nun estudo clínico, o indicador HbA1s diminuíu estatisticamente de forma significativa - un 0,76% (desde o nivel medio - 8,8%).
Farmacocinética
Aspiración. Cando se toma cun estómago baleiro, a vildagliptina absorbe rapidamente, Tmáx - 1,75 horas despois da administración. Coa inxestión simultánea de alimentos, a taxa de absorción de vildagliptina diminúe lixeiramente: hai unha diminución da Cmáx 19% e aumento da Tmáx ata 2,5 horas. Non obstante, a alimentación non afecta o grao de absorción e as ASC.
A Vildagliptina absorbe rapidamente e a súa biodisponibilidade absoluta despois da administración oral é do 85%. Cmáx e AUC no rango de dose terapéutica aumentan aproximadamente en proporción á dose.
Distribución. O grao de unión da vildagliptina ás proteínas plasmáticas é baixo (9,3%). A droga distribúese uniformemente entre plasma e glóbulos vermellos. A distribución de Vildagliptin ocorre presuntamente extravascular, Vss despois da administración iv é de 71 litros.
Metabolismo. A biotransformación é a principal vía de excreción da vildagliptina. No corpo humano, o 69% da dose do medicamento é convertida. O principal metabolito, LAY151 (57% da dose), é farmacológicamente inactivo e é un produto da hidrólise do cianocomponente. Ao redor do 4% da dose do medicamento está sometida a hidrólise da amida.
En estudos experimentais, obsérvase un efecto positivo da DPP-4 na hidrólise do fármaco. A Vildagliptin non se metaboliza coa participación de isoenzimas do citocromo P450. Segundo a investigación in vitro , a vildagliptina non é un substrato de isoenzimas P450, non inhibe e non induce isoenzimas do citocromo P450.
A cría. Despois da inxestión do medicamento, preto do 85% da dose é excretada polos riles e un 15% a través dos intestinos, a excreción renal da vildagliptina non modificada é do 23%. Coa on / na introdución da T media1/2 alcanza as 2 horas, a eliminación plasmática total e a eliminación renal de vildagliptina son 41 e 13 l / h, respectivamente. T1/2 despois da inxestión é de aproximadamente 3 horas, independentemente da dose.
Grupos especiais de pacientes
O xénero, o índice de masa corporal e a etnia non afectan á farmacocinética da vildagliptina.
Función hepática deteriorada. En pacientes con alteración da función hepática de gravidade leve a moderada (6-10 puntos segundo a clasificación Child-Pugh), despois dun único uso do medicamento, hai unha diminución da biodisponibilidade de vildagliptina nun 8 e 20%, respectivamente. En pacientes con disfunción hepática grave (12 puntos segundo a clasificación Child-Pugh), a biodisponibilidade da vildagliptina aumenta un 22%. O cambio máximo na biodisponibilidade de vildagliptin, un aumento ou diminución de media ata un 30%, non é clínicamente significativo. Non se detectou unha correlación entre a gravidade da función hepática deteriorada e a biodisponibilidade do fármaco.
Función renal deteriorada. En pacientes con insuficiencia renal, leve, moderada ou grave ASC, a vildagliptin aumentou 1,4, 1,7 e 2 veces con este indicador en voluntarios sans, respectivamente. A AUC do metabolito LAY151 aumentou 1,6, 3,2 e 7,3 veces, e o metabolito BQS867 aumentou 1,4, 2,7 e 7,3 veces en pacientes con función renal de leve, moderada e grave respectivamente. Os datos limitados en pacientes con enfermidade renal crónica en fase final (CKD) indican que os indicadores deste grupo son similares aos de pacientes con insuficiencia renal grave. A concentración de metabolito LAY151 en pacientes con CKD en fase final aumentou 2-3 veces en comparación coa concentración en pacientes con insuficiencia renal grave. A retirada de vildagliptin durante a hemodiálise é limitada (3% durante un procedemento que dura máis de 3-4 horas 4 horas despois dunha única dose).
Pacientes ≥65 anos. O máximo aumento da biodisponibilidade do medicamento nun 32% (aumento de Cmáx 18%) en pacientes maiores de 70 anos non é clínicamente significativo e non afecta a inhibición de DPP-4.
Pacientes ≤18 anos. Non se estableceron as características farmacocinéticas de vildagliptin en nenos e adolescentes menores de 18 anos.
Aspiración. A biodisponibilidade absoluta de metformina cando se inxeriu a unha dose de 500 mg nun estómago baleiro foi do 50-60%. Tmáx en plasma - 1,81-2,69 horas despois da administración. Con un aumento na dose do medicamento de 500 a 1500 mg ou en doses de 850 a 2250 mg no interior, notouse un aumento máis lento dos parámetros farmacocinéticos (do que sería de esperar para unha relación lineal). Este efecto débese non tanto a un cambio na eliminación da droga como a unha desaceleración na súa absorción. No contexto da inxestión de alimentos, o grao e a taxa de absorción de metformina tamén diminuíron lixeiramente. Así, cunha soa dose do medicamento a unha dose de 850 mg, observouse unha diminución de C co alimentomáx e AUC ao redor do 40 e 25% e un aumento da Tmáx durante 35 minutos Non se estableceu a importancia clínica destes feitos.
Distribución. Cunha única dose oral de 850 mg, V aparented A metformina é (654 ± 358) l. A droga practicamente non se une ás proteínas plasmáticas, mentres que os derivados da sulfonilurea únense a eles máis dun 90%. A metformina penetra nos glóbulos vermellos (probablemente o fortalecemento deste proceso co paso do tempo). Cando se usa metformina segundo o réxime estándar (dose estándar e frecuencia de administración) Css o medicamento no plasma sanguíneo chégase nun prazo de 24 a 48 horas e, por regra xeral, non exceda de 1 μg / ml. En ensaios clínicos controlados de Cmáx A metformina no plasma non superou os 5 mcg / ml (incluso cando se tomou en doses altas).
Metabolismo. Cunha única administración intravenosa de metformina a voluntarios sans, é excretado polos riles sen cambios. Neste caso, o fármaco non se metaboliza no fígado (non se detectaron metabolitos en humanos) e non se excreta na bilis.
A cría. Dado que a eliminación renal da metformina é aproximadamente 3,5 veces superior á clearance da creatinina, o principal xeito de eliminar o fármaco é a secreción tubular. Cando se inxire, aproximadamente o 90% da dose absorbida é excretada polos riles durante as primeiras 24 horas, con T1/2 a partir do plasma sanguíneo é de aproximadamente 6,2 horas1/2 A metformina en sangue enteira é de aproximadamente 17,6 horas, o que indica a acumulación dunha porción significativa da droga nos glóbulos vermellos.
Grupos especiais de pacientes
Paul Non afecta a farmacocinética da metformina.
Función hepática deteriorada. En pacientes con insuficiencia hepática, non se realizou un estudo das características farmacocinéticas da metformina.
Función renal deteriorada. En pacientes con insuficiencia renal (medido pola depuración da creatinina) T1/2 A metformina do plasma e do sangue enteiro aumenta, ea súa eliminación renal diminúe en proporción a unha diminución do depuración de creatinina.
Pacientes ≥65 anos. Segundo estudos farmacocinéticos limitados, en persoas saudables de 65 anos de idade, houbo unha diminución da eliminación plasmática total de metformina e un aumento da T1/2 e Cmáx en comparación con estes indicadores nos mozos. Estas farmacocinéticas da metformina en individuos maiores de 65 anos están probablemente asociadas principalmente a cambios na función renal e, polo tanto, en pacientes con máis de 80 anos, Galvus Met só é posible coa liberación normal da creatinina.
Pacientes ≤18 anos. Non se estableceron as características farmacocinéticas da metformina en nenos e adolescentes menores de 18 anos.
Pacientes de diferente etnia. Non hai evidencias do efecto da etnia do paciente sobre as características farmacocinéticas da metformina. En estudos clínicos controlados de metformina en pacientes con diabetes mellitus tipo 2 de diferente etnia, o efecto hipoglucémico do medicamento manifestouse na mesma medida.
Os estudos mostran bioequivalencia en termos de AUC e Cmáx Galvus Met en 3 dosis diferentes (50 mg + 500 mg, 50 mg + 850 mg e 50 mg + 1000 mg) e vildagliptin e metformina, tomadas en doses adecuadas en comprimidos separados.
A alimentación non afecta o grao e a taxa de absorción de vildagliptina na composición do medicamento Galvus Met. Valores Cmáx e AUC de metformina na composición do medicamento Galvus Met mentres tomaba con alimentos diminuíron un 26 e 7%, respectivamente. Ademais, no contexto da inxestión de alimentos, a absorción de metformina ralentizou, o que provocou un aumento da Tmáx (De 2 a 4 horas) Semellante cambio Cmáx e as AUC con inxestión de alimentos tamén se notaron no caso do uso de metformina por separado. Non obstante, no último caso, os cambios foron menos significativos. O efecto dos alimentos na farmacocinética da vildagliptina e a metformina na composición do medicamento Galvus Met non difería da de tomar ambos os fármacos por separado.
Indicacións Galvus Met ®
A diabetes mellitus tipo 2 (en combinación con terapia dietética e exercicio):
con eficacia insuficiente da monoterapia con vildagliptina ou metformina,
en pacientes que antes recibían terapia combinada con vildagliptina e metformina en forma de medicamentos individuais,
en combinación con derivados de sulfonilurea (terapia de triple combinación) en pacientes previamente tratados con derivados de sulfonilurea e metformina sen un control glicémico adecuado,
en terapia de triple combinación con insulina en pacientes que antes recibiron insulinoterapia nunha dose estable e metformina sen lograr un control glicémico adecuado,
como terapia inicial en pacientes con diabetes mellitus tipo 2 con eficacia insuficiente da terapia dietética, exercicio e necesidade de mellorar o control glicémico.
Contraindicacións
hipersensibilidade á vildagliptina ou metformina ou a calquera outro compoñente do medicamento,
insuficiencia renal ou alteración da función renal (cunha concentración sérica de creatinina ≥1,5 mg% (> 135 μmol / L) - para homes e ≥1,4 mg% (> 110 μmol / L) - para mulleres),
condicións agudas con risco de desenvolver disfunción renal: deshidratación (con diarrea, vómitos), febre, enfermidades infecciosas graves, condicións de hipoxia (choque, sepsis, infeccións nos riles, enfermidades broncopulmonarias),
insuficiencia cardíaca aguda e crónica, infarto agudo de miocardio, insuficiencia cardiovascular aguda (choque), insuficiencia respiratoria,
alteración da función hepática,
acidosis metabólica aguda ou crónica (incluída a cetoacidosis diabética en combinación con ou sen coma), cetoacidosis diabética (debe ser corrixida por insulinoterapia), acidosis láctica (incluída a historia),
antes da cirurxía, radioisótopo, estudos de raios X coa introdución de axentes de contraste: o medicamento non se prescribe durante 48 horas e dentro de 48 horas despois de que se realicen,
diabetes tipo 1
alcoholismo crónico, intoxicación por alcohol aguda,
adhesión a unha dieta baixa en calor (menos de 1000 kcal / día),
nenos menores de 18 anos (a eficacia e a seguridade non están establecidas).
Dado que nalgúns casos os pacientes con alteración da función hepática tiñan acidosis láctica, que é probablemente un dos efectos secundarios da metformina, Galvus Met non se debe usar en pacientes con enfermidades hepáticas ou parámetros bioquímicos da función hepática.
Con coidado: pacientes maiores de 60 anos cando realizan un traballo físico pesado debido a un maior risco de acidosis láctica.
Embarazo e lactación
En estudos experimentais en animais con uso de vildagliptina en doses 200 veces superiores ao recomendado, o fármaco non causou unha violación do desenvolvemento precoz do embrión e non exercía un efecto teratogénico. Cando se usa vildagliptina en combinación con metformina nunha proporción de 1:10, tampouco se detectou un efecto teratoxénico.
Como non hai datos suficientes sobre o uso do medicamento Galvus Met en mulleres embarazadas, o uso do medicamento durante o embarazo está contraindicado.
A metformina pasa ao leite materno. Non se sabe se a vildagliptina se excreta no leite materno. Está contraindicado o uso do medicamento Galvus Met durante a lactación.
Efectos secundarios
Os datos a continuación refírense ao uso de vildagliptina e metformina en monoterapia e en combinación.
Como resultado da terapia con vildagliptin, raramente se observou unha función hepática deteriorada (incluída a hepatite). Na maioría dos casos, estas violacións e desviacións dos índices de función hepática da norma resolveuse por conta propia sen complicacións despois da interrupción da terapia farmacéutica. Cando se aplica vildagliptin a unha dose de 50 mg 1 ou 2 veces ao día, a frecuencia de aumento da actividade das enzimas hepáticas (ALT ou ACT 3 veces superior á VGN) foi do 0,2 ou do 0,3%, respectivamente (comparado co 0,2% no grupo control) . Un aumento da actividade dos encimas hepáticos na maioría dos casos foi asintomático, non progresou e non estivo acompañado de colestase ou ictericia.
Utilizáronse os seguintes criterios para valorar a incidencia de eventos adversos (AE): moi a miúdo (≥1 / 10), a miúdo (≥1 / 100, GIT), a taxa de AE en comparación coa terapia combinada con vildagliptina e metformina foi do 12,9%. observado no 18,1% dos pacientes.
Nos grupos de pacientes que recibiron metformina en combinación con vildagliptin, notáronse trastornos gastrointestinais cunha frecuencia do 10-15% e no grupo de pacientes que recibiron metformina en combinación con placebo, cunha frecuencia do 18%.
Os ensaios clínicos a longo prazo de ata 2 anos non revelaron desviacións adicionais no perfil de seguridade nin riscos imprevistos ao usar vildagliptin como monoterapia.
Un estudo sobre o uso dunha combinación de vildagliptina e metformina como terapia inicial para a diabetes mellitus tipo 2 non revelou ningún risco e datos de seguridade adicionais.
O uso de vildagliptin simultaneamente coa insulina
En ensaios clínicos controlados co uso de vildagliptin a unha dose de 50 mg 2 veces ao día en combinación con insulina en combinación con metformina ou sen ela, a frecuencia de interrupción da terapia debido ao desenvolvemento de reaccións adversas foi do 0,3% no grupo vildagliptina, mentres que no grupo placebo non houbo retirada de terapia.
A incidencia de hipoglucemia foi comparable en ambos os grupos (14% no grupo vildagliptina e 16,4% no grupo placebo). No grupo vildagliptin, notáronse casos de hipoglucemia grave en 2 pacientes, no grupo placebo - en 6.
No momento en que se completou o estudo, o medicamento non afectou o peso corporal medio (o peso corporal aumentou 0,6 kg en comparación co orixinal no grupo vildagliptin e non se observaron cambios no grupo placebo).
A continuación móstranse os AE en pacientes que reciben vildagliptina 50 mg 2 veces ao día en combinación con insulina (con ou sen metformina).
Do sistema nervioso: moitas veces unha dor de cabeza.
Do tracto gastrointestinal: a miúdo - náuseas, refluxo gastroesofágico, raramente - diarrea, flatulencia.
Do lado do metabolismo e da nutrición: a miúdo - hipoglucemia.
Trastornos xerais e trastornos no lugar da inxección: a miúdo - calafríos.
Cando se usa vildagliptin en combinación con preparacións de sulfonilurea
Non se notaron casos de interrupción do fármaco asociados ao desenvolvemento de AE no grupo de terapia combinada con vildagliptin, metformina e glimepirida. Na terapia combinada de placebo, metformina e glimepirida, a incidencia de AE foi do 0,6%.
A hipoglicemia a miúdo foi observada en ambos grupos (5,1% no grupo de terapia combinada con vildagliptina, metformina e glimepirida e 1,9% no grupo de terapia combinada con placebo, metformina e glimepirida). No grupo de vildagliptina, notouse un episodio de hipoglucemia grave.
Cando se completou o estudo, non se detectou ningún efecto significativo sobre o peso corporal (+0,6 kg no grupo vildagliptin e –0,1 kg no grupo placebo).
A continuación, preséntanse AEs en pacientes que reciben vildagliptina 50 mg 2 veces ao día en combinación con metformina e sulfonilureas.
Do sistema nervioso: moitas veces - mareos, tremor.
Trastornos xerais e trastornos no lugar da inxección: moitas veces fatiga.
Do lado do metabolismo e da nutrición: a miúdo - hipoglucemia.
Por parte da pel e do tecido subcutáneo: a miúdo - hiperhidrose.
Ao usar vildagliptina como monoterapia
Do sistema nervioso: a miúdo - mareos, raramente - cefalea.
Do tracto gastrointestinal: raramente - estreñimiento.
Por parte da pel e do tecido subcutáneo: raramente - erupción cutánea.
Do lado do tecido músculo-esquelético e conectivo: a miúdo - artralxia.
Trastornos xerais e trastornos no lugar da inxección: raramente - edema periférico.
Cando se usou terapia combinada con vildagliptina e metformina, non se observou un aumento clínicamente significativo da frecuencia dos AE mencionados anteriormente con vildagliptin.
No contexto da monoterapia con vildagliptina ou metformina, a incidencia de hipoglucemia foi do 0,4% (con pouca frecuencia).
A monoterapia con vildagliptina e o tratamento combinado de vildagliptina + metformina non afectaron o peso corporal do paciente.
Os ensaios clínicos a longo prazo de ata 2 anos non revelaron desviacións adicionais no perfil de seguridade nin riscos imprevistos ao usar vildagliptin como monoterapia.
No período posterior á comercialización identificáronse as seguintes reaccións adversas (dado que os datos se informan de xeito voluntario dunha poboación de tamaño indefinido, non é posible determinar de xeito fiable a frecuencia de desenvolvemento destes ES, e polo tanto clasifícanse como a frecuencia descoñécese): hepatite (reversible cando se detén a terapia), urticaria, pancreatite, lesións cutáneas bulosas e exfoliativas.
Cando se usa metformina en monoterapia
Do lado do metabolismo e da nutrición: moi a miúdo - perda de apetito, moi raramente - acidosis láctica.
Do tracto gastrointestinal: moi a miúdo - flatulencias, náuseas, vómitos, diarrea, dor abdominal, a miúdo - disguusia.
Por parte do fígado e do tracto biliar: moi raramente - hepatite.
Por parte da pel e do tecido subcutáneo: moi raramente - reaccións cutáneas (en particular eritema, prurito, urticaria).
Datos de laboratorio e instrumentais: moi raramente: redución da absorción de vitamina B12, cambio nos índices de función hepática.
Diminución da absorción de vitamina B12 e unha diminución da súa concentración no soro sanguíneo co uso de metformina foi moi raramente observada en pacientes que recibiron o medicamento durante moito tempo e, por regra xeral, non representaba importancia clínica. Débese considerar a redución da absorción de vitamina B12 en pacientes con anemia megaloblástica.
Algúns casos de hepatite, que se observaron co uso de metformina, resolvéronse despois da súa retirada.
Interacción
Co uso simultáneo de vildagliptina (100 mg 1 vez ao día) e metformina (1000 mg 1 vez ao día), non se observou PCF clínicamente significativa entre eles. Nin durante os ensaios clínicos, nin durante o amplo uso clínico de Galvus Met en pacientes que recibían simultaneamente outros medicamentos e substancias, non se detectaron interaccións imprevistas.
Vildagliptin ten un baixo potencial de interacción con fármacos. Dado que a vildagliptina non é un substrato de encimas citocromos P450, nin inhibe nin induce estas isoenzimas, é pouco probable a súa interacción con fármacos que son substratos, inhibidores ou indutores de P450. O uso simultáneo de vildagliptina non afecta a taxa metabólica de fármacos que son substratos de enzimas: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 e CYP3A4 / 5.
Non se estableceu unha interacción clínicamente significativa de vildagliptina con fármacos máis empregados no tratamento da diabetes mellitus tipo 2 (glibenclamida, pioglitazona, metformina) ou que ten un rango terapéutico estreito (amlodipina, digoxina, ramipril, simvastatina, valsartan, warfarina).
Furosemida aumenta Cmáx e AUC de metformina, pero non afecta a súa eliminación renal. A metformina baixa a Cmáx e AUC de furosemida e tampouco afecta a súa eliminación renal.
Nifedipina aumenta a absorción, Cmáx e AUC de metformina, ademais, aumenta a súa excreción polos riles. A metformina practicamente non afecta aos parámetros farmacocinéticos da nifedipina.
Glibenclamida non afecta aos parámetros farmacocinéticos / farmacodinámicos da metformina. A metformina xeralmente baixa a Cmáx e AUC de glibenclamida, con todo, a magnitude do efecto varía moito. Por este motivo, a importancia clínica desta interacción segue sen ser clara.
Catións orgánicospor exemplo, amilorida, digoxina, morfina, procainamida, quinidina, quinina, ranitidina, triamtereno, trimetoprim, vancomicina e outros, excretados polos riles por secreción tubular, poden teóricamente interactuar con metformina debido á competencia por sistemas comúns de transporte de túbulos renales. Así, a cimetidina aumenta tanto a concentración de metformina no plasma sanguíneo como a súa AUC nun 60 e 40% respectivamente. A metformina non afecta os parámetros farmacocinéticos da cimetidina. Débese ter precaución ao usar Galvus Met xunto con medicamentos que afectan a función renal ou a distribución de metformina no corpo.
Outras drogas. Algúns fármacos poden causar hiperglucemia e reducir a eficacia dos axentes hipoglucémicos. Estes medicamentos inclúen tiazidas e outros diuréticos, GCS, fenotiazinas, preparados de hormonas tiroideas, estróxenos, anticonceptivos orais, fenitoína, ácido nicotínico, simpatomiméticos, antagonistas de calcio e isoniazidas. Co uso simultáneo de tales fármacos ou, pola contra, no caso da súa retirada, recoméndase vixiar coidadosamente a eficacia da metformina (o seu efecto hipoglucémico) e, se é necesario, axustar a dose do medicamento. Non se recomenda o uso concomitante danazol co fin de evitar a acción hiperglicémica deste último. Se é necesario un tratamento con danazol e despois de deixar de administrar este último, é necesario o axuste da dose de metformina baixo o control da concentración de glicosa no sangue.
Clorpromazina cando se usa en grandes doses (100 mg por día), aumenta a glicemia, reducindo a liberación de insulina. No tratamento dos antipsicóticos e despois de deterse este último, o axuste da dose do medicamento Galvus Met é necesario baixo o control da concentración de glicosa no sangue.
Axentes radiopaco que conteñen iodo: un estudo radiolóxico que usa axentes radiopaques que conteñen iodo pode provocar o desenvolvemento de acidosis láctica en pacientes con diabetes mellitus con insuficiencia renal funcional.
Β inxectable2simpatomiméticos: aumenta a glicemia debido á estimulación de β2-adrenoreceptores. Neste caso, é necesario un control glicémico. Se é necesario, recoméndase insulina.
Co uso simultáneo de metformina con derivados de sulfonilurea, insulina, acarbosa, salicilatos, é posible un aumento do efecto hipoglucémico.
Dado que o uso de metformina en pacientes con intoxicación aguda con alcohol aumenta o risco de acidosis láctica (especialmente durante a fame, o esgotamento ou a insuficiencia hepática), no tratamento con Galvus Met, debes absterse de beber alcol e drogas que conteñan alcohol etílico.
Dosificación e administración
O réxime de dosificación do medicamento Galvus Met debe seleccionarse individualmente, dependendo da eficacia e da tolerabilidade da terapia. Ao usar Galvus Met, non exceda a dose máxima diaria recomendada de vildagliptin (100 mg).
A dose inicial recomendada de Galvus Met debe seleccionarse tendo en conta a duración do curso de diabetes e o nivel de glicemia, a condición do paciente e o réxime de tratamento de vildagliptina e / ou metformina xa empregados no paciente. Para reducir a gravidade dos efectos secundarios do tracto dixestivo, característico da metformina, Galvus Met tómase con comida.
A dose inicial do medicamento Galvus Met coa ineficacia da monoterapia con vildagliptina
O tratamento pode iniciarse con 1 comprimido. (50 mg + 500 mg) 2 veces ao día, despois de avaliar o efecto terapéutico, a dose pode aumentar gradualmente.
A dose inicial do medicamento Galvus Met co fracaso da monoterapia con metformina
Dependendo da dose de metformina xa tomada, o tratamento con Galvus Met pode iniciarse con 1 comprimido. (50 mg + 500 mg, 50 mg + 850 mg ou 50 mg + 1000 mg) 2 veces ao día.
A dose inicial do medicamento Galvus Met en pacientes que antes recibían terapia combinada con vildagliptina e metformina en forma de comprimidos separados
Dependendo das doses de vildagliptina ou metformina xa tomadas, o tratamento con Galvus Met debería comezar cunha tableta o máis próxima posible á dosificación do tratamento existente (50 mg + 500 mg, 50 mg + 850 mg ou 50 mg + 1000 mg) e axustar a dose a dependendo da eficacia.
A dose inicial do medicamento Galvus Met como terapia inicial en pacientes con diabetes mellitus tipo 2 con eficacia insuficiente da terapia dietética e exercicio
Como terapia inicial, Galvus Met debe prescribirse nunha dose inicial de 50 mg + 500 mg unha vez ao día e, despois de avaliar o efecto terapéutico, aumentar gradualmente a dose ata 50 mg + 1000 mg 2 veces ao día.
Terapia combinada con Galvus Met e derivados da sulfonilurea ou insulina
A dose de Galvus Met calcúlase a partir dunha dose de vildagliptin 50 mg × 2 veces ao día (100 mg ao día) e metformina nunha dose igual á anteriormente tomada como fármaco único.
Grupos especiais de pacientes
Función renal deteriorada. En pacientes con insuficiencia renal, pode ser necesario un axuste da dose con creatinina Cl (calculada coa fórmula de Cockcroft-Gault) comprendida entre 60 e 90 ml / min. O uso do medicamento Galvus Met en pacientes con creatinina Cl VGN 2 veces). Cun aumento da dose de vildagliptina a 600 mg / día, é posible o desenvolvemento de edema das extremidades, acompañado de parestesia e un aumento da concentración de CPK, proteína C-reactiva e mioglobina e actividade AST. Todos os síntomas dunha sobredose e cambios nos parámetros de laboratorio desaparecen despois da interrupción do medicamento.
Tratamento: a eliminación do medicamento do corpo a través da diálise é pouco probable. Non obstante, o metabolito hidrolítico principal da vildagliptina (LAY151) pode ser eliminado do corpo por hemodiálise.
Síntomas varios casos de sobredosis de metformina, incluído como consecuencia da inxestión do fármaco nunha cantidade superior a 50 g. Con sobredose de metformina, observouse hipoglucemia en preto do 10% dos casos (con todo, a súa relación co fármaco non estaba establecida). No 32% dos casos, notouse acidosis láctica. Os primeiros síntomas da acidosis láctica son náuseas, vómitos, diarrea, diminución da temperatura corporal, dor abdominal, dor muscular e pode haber unha maior respiración, mareos, conciencia deteriorada e o desenvolvemento de coma.
Tratamento: sintomático, baseado no estado do paciente e nas manifestacións clínicas. Elimínase do sangue mediante hemodiálise (con depuración de ata 170 ml / min) sen o desenvolvemento de trastornos hemodinámicos. Así, pódese empregar hemodiálise para eliminar metformina do sangue en caso de sobredose do medicamento.
Instrucións especiais
En pacientes que reciben insulina, Galvus Met non pode substituír a terapia con insulina.
Función hepática deteriorada. Dado que ao aplicar vildagliptina, notouse un aumento na actividade das aminotransferases (normalmente sen manifestacións clínicas) con máis frecuencia que no grupo control, recoméndase determinar os parámetros bioquímicos da función hepática antes de usar o medicamento Galvus Met, así como regularmente durante o tratamento. Se se detecta un aumento da actividade das aminotransferases, debería realizarse un estudo repetido para confirmar o resultado e, a continuación, determinar regularmente os parámetros bioquímicos da función hepática ata que se normalicen. Se o exceso de actividade AST ou ALT é 3 ou máis veces superior á VGN confirmada por investigacións repetidas, recoméndase cancelar o medicamento.
Acidosis láctica. A acidosis láctica é unha complicación metabólica moi rara pero grave que se produce coa acumulación de metformina no corpo. A acidosis lactica co uso de metformina foi observada principalmente en pacientes con diabetes mellitus con insuficiencia renal grave. O risco de desenvolver acidosis láctica aumenta en pacientes con diabetes mellitus mal tratable, con cetoacidosis, inanición prolongada, abuso prolongado de alcohol, alteración da función hepática e enfermidades causantes de hipoxia.
Co desenvolvemento da acidosis láctica, notan falta de respiración, dor abdominal e hipotermia, seguida de coma. Os seguintes indicadores de laboratorio teñen un valor diagnóstico: unha diminución do pH do sangue, unha concentración de lactato no soro por encima de 5 nmol / L, así como un incremento do intervalo aniónico e un aumento da relación de lactato / piruvato. Se se sospeita de acidosis láctica, o medicamento debe ser interrumpido e o paciente inmediatamente hospitalizado.
Supervisión da función renal. Dado que a metformina é en gran parte excretada polos riles, o risco da súa acumulación e desenvolvemento da acidosis láctica aumenta en proporción á gravidade da disfunción renal. Ao usar o medicamento, Galvus Met debe avaliar regularmente a función renal, especialmente en condicións que contribúen ao seu deterioro, como a fase inicial do tratamento con fármacos antihipertensivos, axentes hipoglicémicos ou AINE. A función renal debe valorarse antes de comezar o tratamento con Galvus Met, e polo menos 1 vez ao ano en pacientes con función renal normal e polo menos 2-4 veces ao ano en pacientes con depuración de creatinina no nivel normal máis baixo, así como nos anciáns. pacientes. En pacientes con alto risco de desenvolver disfunción renal, a monitorización debe realizarse con máis frecuencia de 2 a 4 veces ao ano. Se aparecen signos de insuficiencia da función renal, Galvus Met debe ser interrompido.
Uso de axentes radiopaco que conteñen iodo para a administración intravascular. Cando se realizan estudos de radiografías que requiren administración intravascular de axentes radiopaque que conteñen iodo, o Galvus Met debe ser interrompido temporalmente (48 horas antes, e tamén dentro de 48 horas despois do estudo), xa que a administración intravascular de axentes radiopaco que contén iodo pode provocar un forte deterioro da función renal e aumentar. risco de acidosis láctica. Retomar a toma do medicamento Galvus Met segue só despois dunha reavaliación da función renal.
Hipoxia. En insuficiencia cardiovascular aguda (choque), insuficiencia cardíaca aguda, infarto agudo de miocardio e outras condicións caracterizadas por hipoxia, é posible o desenvolvemento de acidosis láctica e insuficiencia renal aguda prerenal. Se se dan as condicións anteriores, a droga debe ser interrumpida inmediatamente.
Intervencións cirúrxicas. Durante as intervencións cirúrxicas (con excepción de pequenas operacións que non están relacionadas coa limitación da inxestión de alimentos e líquidos), o medicamento Galvus Met debe ser interrompido. A reanudación do medicamento é posible despois da restauración da inxestión oral de alimentos en pacientes con función renal alterada significativamente.
Beber alcol. Comprobouse que o alcohol aumenta o efecto da metformina no metabolismo do lactato. Os pacientes deben ser advertidos sobre a inadmisibilidade do abuso de alcol durante o uso do medicamento Galvus Met.
Deterioración en pacientes con diabetes tipo 2 que responderon previamente á terapia. Se se detectan desviacións de laboratorio da norma ou aparecen síntomas clínicos que a condición xeral empeora (especialmente con síntomas non claros e borrosos) en pacientes con resposta adecuada previa á terapia, os diagnósticos de laboratorio deberían realizarse de inmediato para detectar cetoacidosis e / ou acidosis láctica. Se se detecta acidosis, debería deixar inmediatamente o uso do medicamento e tomar as medidas necesarias para corrixir o estado do paciente.
Hipoglicemia. Normalmente, en pacientes que reciben só Galvus Met, non se observa hipoglucemia, pero pode ocorrer nun contexto dunha dieta baixa en calorías (cando a actividade física intensa non se compensa polo contido calórico do alimento) ou no fondo do consumo de alcol. O desenvolvemento da hipoglucemia é máis probable en pacientes anciáns, debilitados ou esgotados, así como no contexto de hipopituitarismo, insuficiencia suprarrenal ou intoxicación por alcohol. En pacientes anciáns e en aqueles que reciben β-bloqueantes, o diagnóstico de hipoglucemia pode ser difícil.
Diminución da eficacia dos axentes hipoglucémicos. Baixo o estrés (incluíndo febre, trauma, infección, cirurxía), desenvolvéndose en pacientes que reciben axentes hipoglucémicos segundo o esquema estándar, é posible unha forte diminución da eficacia destes últimos durante algún tempo. Neste caso, pode ser necesario interromper temporalmente o medicamento Galvus Met e a insulina. A reanudación do tratamento con Galvus Met é posible despois do final do período agudo.
Fertilidade. En estudos experimentais en animais, o uso de vildagliptina en doses 200 veces superiores ás recomendadas non causou trastornos de fertilidade.
Non houbo ningún efecto negativo sobre a fertilidade en homes e mulleres co uso de metformina en doses de 600 mg / kg / día, que é aproximadamente 3 veces maior que a dose recomendada para humanos (cando se converte na área corporal). Non se realizou un estudo sobre o efecto sobre a fertilidade humana.
Influencia na capacidade para conducir vehículos e traballar con mecanismos. Non se estudou o efecto de Galvus Met na capacidade para conducir vehículos e mecanismos. Co desenvolvemento de mareos fronte aos antecedentes do consumo da droga, débese absterse de conducir vehículos e mecanismos.
Fabricante
1. Novartis Pharma Stein AG, Suíza.
2. Novartis Pharma Production GmbH. Oflingerstrasse 44, 79664, Ver, Alemaña.
O titular do certificado de rexistro: Novartis Pharma AG. Lichtstrasse 35, 4056, Basilea, Suíza.
Pódese obter información adicional sobre o medicamento no enderezo: 125315, Moscova, Leningradsky pr-t, 72, Bldg. 3.
Tel .: (495) 967-12-70, fax: (495) 967-12-68.